有機化学I第1回
<-- 2023年回答のうち誤答の正しい分類--> <--過去の回答例はこちら。以下の質問は、「Q&A」に回答があります。
(質問)(化学を専門としないのに)有機化学を学ぶことの意義は何か?
(質問)イオン性物質と分子性物質の区別の仕方は?
(コメント)詳しくは、上の「過去の回答例」のページの冒頭の説明をご覧下さい。
同様の組み合わせであっても、「酸化~」で始まる名前を持つ物質の中には、イオン性物質ではなく無機高分子に分類されるものもあります。
(質問)レシチン(リン脂質を含む脂質製品の総称)は分類できますか。
(質問)着色料はどの分類になりますか?
(質問)「無水ケイ酸」は物質名か?(無機化学命名法)
(質問)有機物の定義は?
(コメント)Q&Aのページのほか、テキストの第1章にも説明があります。
(質問)分子性物質と高分子物質の違いは?
(質問)「有機化学I」では生物体に関する物質や反応について学ぶことはできますか。
(質問)「果糖」を「フルクトース」と呼ぶときがあるが、これはどうしてか。
(質問)有機物の名前からおおよその機能を推測することはできるか。
(質問)演習課題第2回(3)について、「元素組成から分子式を区別する」とはどういうことか。
(質問)結合の極性の有無はどのように判断すればいいのか。
(質問)形式電荷を求めることにより何がわかるのか。
(質問)オクテット則とは何か?
1.(A)(1) Na+ (2) S2- (3) Mg2+ (4) Ne
2.(1) 極性のある(小さい)共有結合 (2) 極性のある(大きい)共有結合
(3) イオン結合 (4) 極性のある(小さい)共有結合
注意:(1)と(4)では、「極性がない」と答えた例が目立ったが、大小の違いはあっても、同一原子間でない限りどんな共有結合にも極性はある。それは、電気陰性度の差として数値化されている。高等学校では簡単のためにC-H結合の極性は「ないと見なしてきた」(これからも多くの場合はそうする)だけである。
また、「分子の極性」は、各結合の極性ベクトルの総和で決まるので、結合に極性があっても、分子には極性がほとんどないか、全くない場合がある。これについては第5章で学ぶが、両者を区別し、見極めることが重要である。
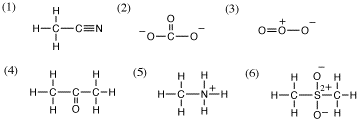
3. (a) (1) H: 0、C(CH3): 4-(1×4) = 0、C(CN): 4-(1+3) = 0、N: 5-(3+2) = 0
(2) C: 4-(1×2+2) = 0、O(左右): 6-(1+2×3) = -1、O(上): 6-(2+2×2) = 0
(3) O(左): 6-(2+2×2) = 0、O(中): 6-(2+1+2) = +1、O(右): 6-(1+2×3) = -1
(4) H: 0、C: 4-(1×4) = 0、O: 6-(2+2×2) = 0
(5) H: 0、C: 4-(1×4) = 0、N: 5-(1×4) = +1
(6) H: 0、C: 4-(1×4) = 0、S: 6-(1×4) = +2、O: 6-(1+2×3) = -1
(b) それぞれ、次のような構造式と対応する。
(1) エタンニトリル(アセトニトリル)、(2) 炭酸イオン、(3) オゾン、(4)プロパノン(アセトン)、(5)メチルアンモニウムイオン、(6)
メタンスルホニルメタン*またはジメチルスルホン(メチルスルホニルメタン)
*IUPACの2013年勧告で推奨名になった。
4.(a) N: +1,化学種がもつ電荷:+1、 (b) N: +1,O(上):-1,O(下):0,化学種がもつ電荷:0、
(c) S: +2,O: -1,化学種がもつ電荷:-1 、 (d) C: -1,化学種がもつ電荷:-1、
(e) P: +1,O:-1, 化学種がもつ電荷:0、 (f) B: -1,F:0, 化学種がもつ電荷:-1
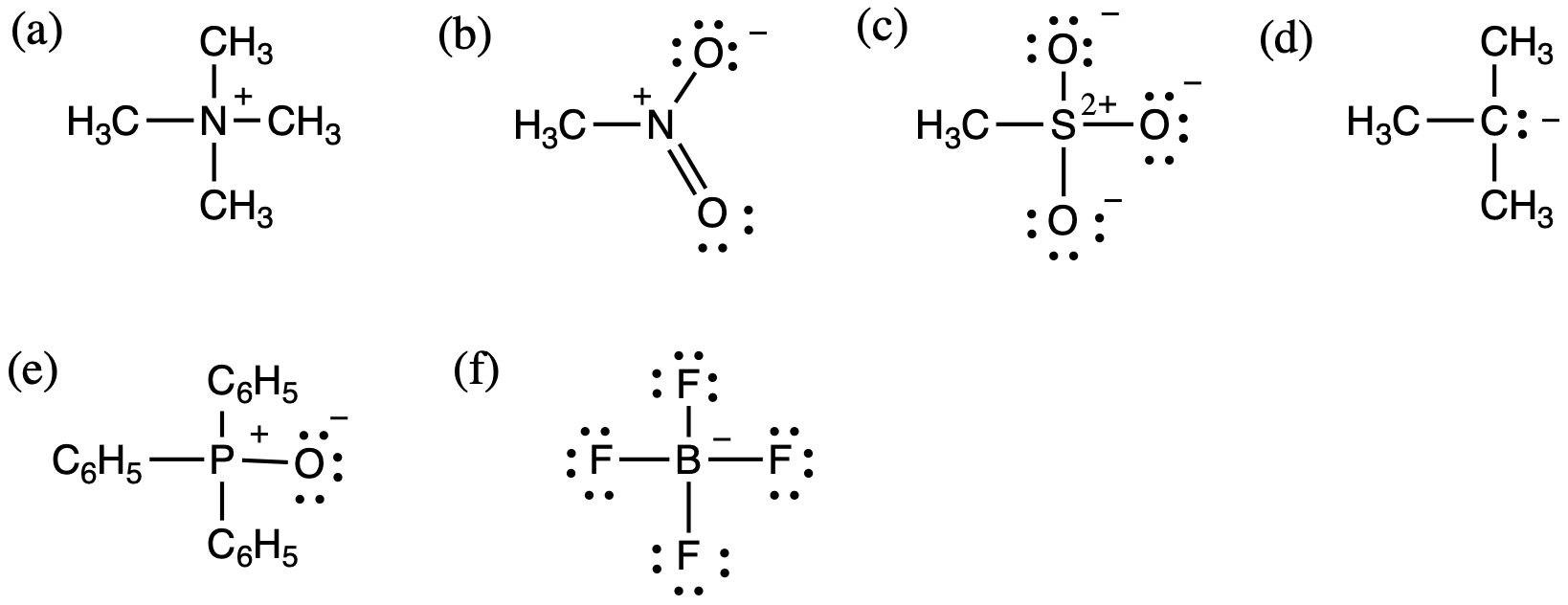
電荷や酸化数では、正の場合にも必ず符号(+)を付けて下さい。
5.(1) Na+ (2) S2- (3) Mg2+ (4) Ne
6.
(1) エネルギー準位:原子番号が大きいほど低くなる。
原子核からの平均距離:原子番号が大きいほど小さくなる。
理由:(例)原子番号が大きいほど、原子核のもつ正電荷が大きくなるため、電子に働くクーロン引力は大きくなる。このため、位置エネルギーは小さくなる。また、電子は原子核に強く引きつけられるので、原子核からの(平均)距離は小さくなる。
(2) エネルギー準位:(例)低いほうから、s < p < d < f...の順に高くなる。
理由:(例)各軌道に入っている電子は、より内側にある電子による遮蔽(しゃへい)効果を受ける。このため、原子核から離れている電子ほど原子核の正電荷から及ぼされるクーロン引力は小さくなる。同じ主量子数の原子軌道では、原子核からの平均距離が、小さいほうから s< p < d < f...の順に大きくなっている。このため、遮蔽効果も同じ順序で大きく受けようになるので、この順序でエネルギー準位が高くなる。
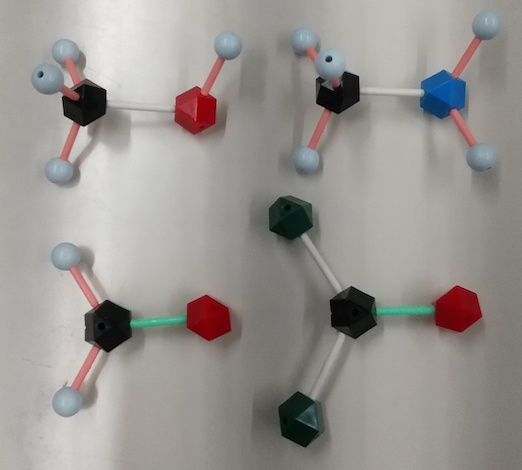
7.(1) (例)くさび形:紙面(画面)から手前向きに伸びる。
点線:紙面(画面)から向こう(奥)向きに伸びる。
丸善HGS模型
 (2) 左が(a)、右が(b)。写真をクリックすると拡大して見れます。
(2) 左が(a)、右が(b)。写真をクリックすると拡大して見れます。
(写真の(b)のC原子の上下にある穴にH原子との結合をつけてしまうと間違った結果になるので注意すること)
(a) ∠HCH = 約110°、∠HCO = 約125°
(b) ∠HCH = 約120°、∠HCO = 約120°
(b)のほうが実際の角度に近い。
モルタロウ使用者
(2) 上の(b)に似た形になる。
∠HCH = 約120°、∠HCO = 約120°
Winmostar を使用する場合は「結合角を変更する」機能で確認できます。
(2) ∠HCH = 約120°、∠HCO = 約120°
8. 考え方:(1) C3H8の分子量:C3: 12.01×3=36.03 H8: 1.01×8=8.08
36.03+8.08=44.11
C: (36.03/44,11)×100=81.7
H: (8.08/44,11)×100=18.3
(1) C: 81.7%, H: 18.3% (2) C: 82.7%, H: 17.3%
(3) C: 85.6%, H: 14.4% (4) C: 85.6%, H: 14.4%
(プラスマイナス0.5%は許容)
8-2(解答例)
(1)と(2)(飽和炭化水素の炭素数の違い)は区別できる。
(1)と(3)、(2)と(4)(飽和炭化水素か不飽和炭化水素か)は区別できる。
(3)と(4)(不飽和炭化水素の炭素数の違い)は区別できない。
炭素数が大きくなると、いずれも区別が困難になりそうだ。
後半の問題は、大学・企業での研究・開発・その他の仕事や社会生活でしばしば遭遇する「正解がいくつかある問題」の典型である。問題文は複数の視点から捉えることができる。自分の視点を明確にして問題文と計算結果を検討し、論理的に考察すれば、何らかの答えに到達するはずである。以上の過程が重要であり、視点を示さずに単に回答したのでは、正解とは言えない。また、複数の可能性があって明確な結論が得られないときは、可能性を列挙した上で「何とも言えない」と回答すればよい。これは「わからない(思考の放棄)」とはまったく異なる。
少なくとも高校~大学入試までは、このような問題にぶつかった経験はあまりないのが普通である。しかし、上のような事情を考えると、このような問題に対応する経験を、大学生の間に何度か経て慣れておくことはとても重要なことである。無回答または視点を意識せず機械的に回答した諸君は、改めて「自分の」回答を考えるとよい。
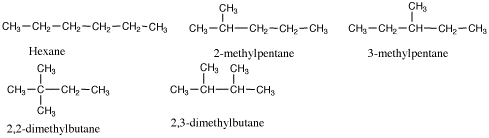
3章 飽和炭化水素
1.(1)a.gif)
(2)
2.(1)(2)解答例(a)(c)(f)(i)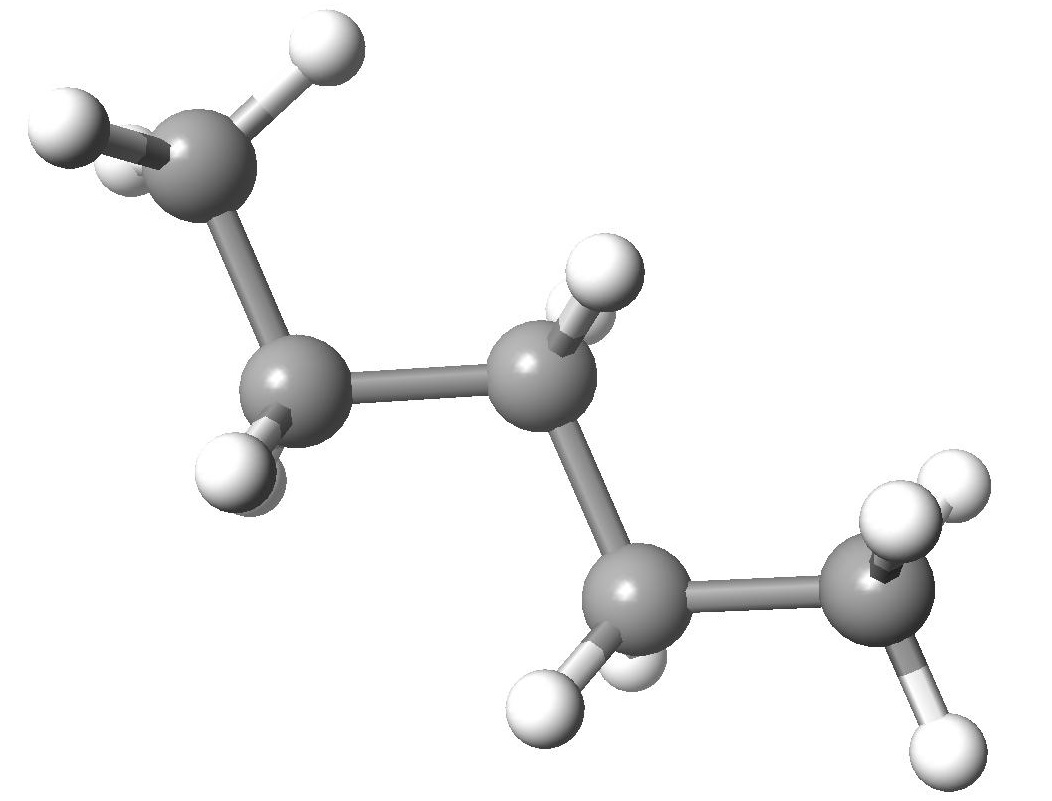 (b)(d)(e)(g)
(b)(d)(e)(g) (h)
(h)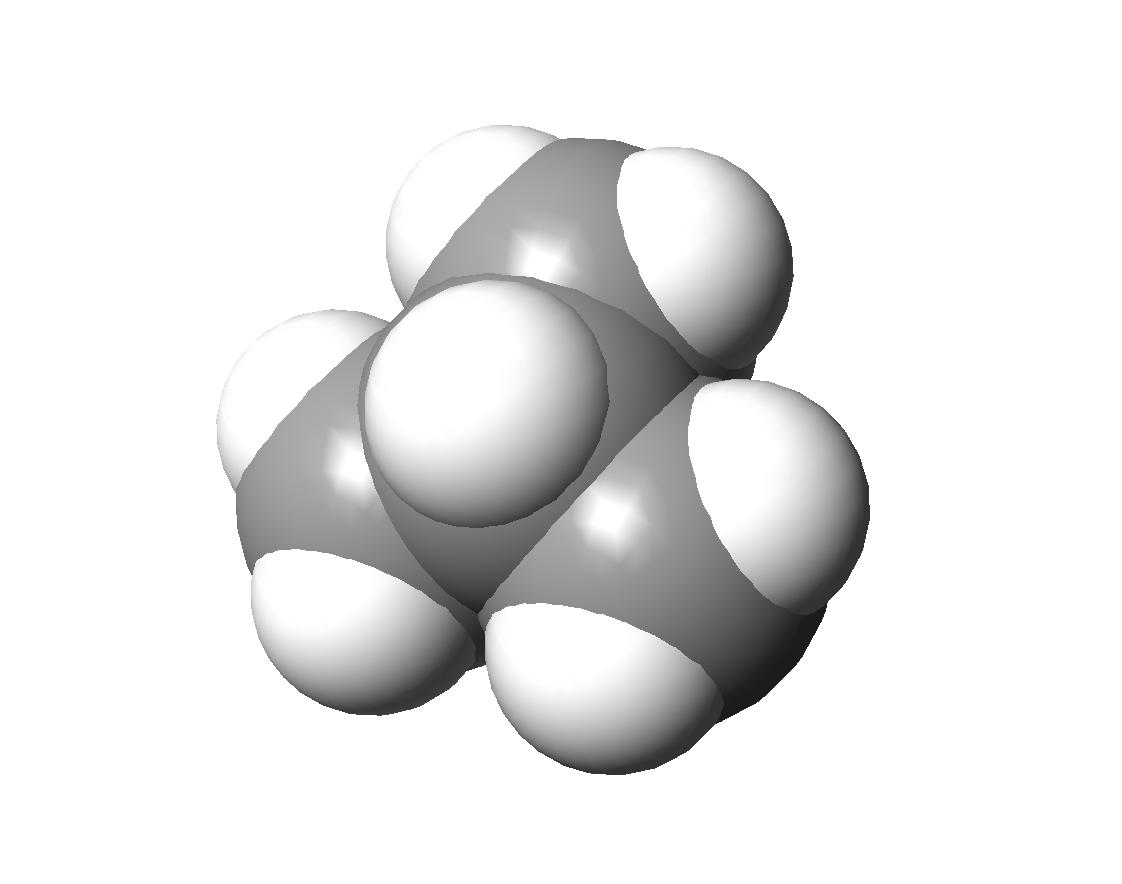
3.
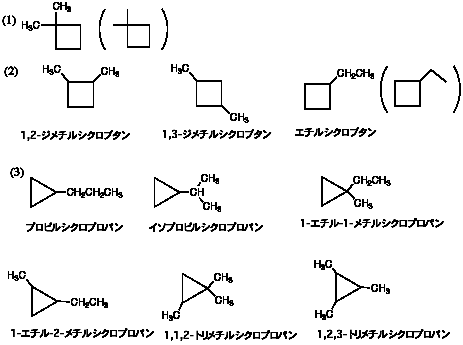
この他にも環状の異性体がある。
2つめの「イソプロピル」は組織名では「1-メチルエチル」なので、「(1-メチルエチル)シクロプロパン」でも正しい(使う人はほとんどいない)。なお、IUPACの1993年の勧告では、isopropyl は propan-2-yl と書いてもいい。しかし「2-プロピル」は誤りである。
4.(1) C10H18, IHD
= 2 (2) C13H22, IHD
= 3 (3) C10H18, IHD
= 2 (4) C10H18, IHD
= 2
(1) (2) は縮合多環炭化水素、(3) は橋架け環炭化水素、(4) はスピロ炭化水素の仲間である。
(5) 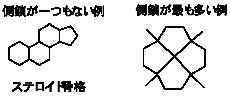 他に多数考えられる。
他に多数考えられる。
ステロイド骨格は、性ホルモンをはじめとして多数の天然物がもっている。
(1)~(4)で与えられている構造はそれぞれ環どうしのつながり方が違っているので、(5)を考える上でヒントになるはずである。
注意:今回のような問題では、設定されている条件をみたしている回答かどうかの判断力が求められています。条件をみたしていない誤答が目立ちました。問題文をよく読み、条件をみたしているかどうかを判断してから回答して下さい。
考えられる限りの条件を自分で設定して(場合分けして)、各条件(場合)を満たしている構造をもれなく描き出すことは、異性体の問題に正しく回答するための重要な手順です。
3-1質問2 結合の回転のしやすさは性質にどのような影響を与えるのか。
(これから学びますが,結合の回転が起こりやすい分子は、一般に分子の形が変わりやすいです。)
3-2質問1:ひずみエネルギーの計測はどのように行われたのか。Good Question!
回答:たとえば、生成エンタルピーの実験値を、ひずみがない分子と比較することで推算することができます。
3-2質問2:ひずみエネルギーを算出する公式はあるのか。Interesting!
回答:推算する方法はありますが,炭素数を代入すれば答えの出る公式のようなものはありません。
4章 不飽和炭化水素
1.(1) 略。
(2) (実際に測って3桁目まで報告してほしい。模型でのプラスマイナス1 mm(実際での0.005 nm)程度の誤差は許容する。)
(a) 0.15 nmくらいか。(b) 0.24 nmくらいか。
(c) 最近接の水素原子どうしがもっとも離れたとき以外は、メチル基どうしは互いに反発する可能性が高い。
(3) (例)(Z)-2-ブテンでの(2) (c) に記したようなメチル基どうしの反発は(E)-2-ブテンでは起らないと考えると、(E)-2-ブテンがより安定だと考えられる。
注意:(2)(b) で、(E)-2-ブテンのメチル基同士の距離を測定した例(0.54 nmくらい)が目立った。
2.
IUPACの1993年および2013年勧告では、1-butene は but-1-ene(ブタ-1-エン)、2-pentene は pent-2-ene(ペンタ-2-エン)のように書くことが推奨されている(海外では1993年以前から使われる場合があった)。しかし、英語綴りと日本語訳とが一致していないためか、国内では普及していない。
注意:E、Z異性体を H | CH3C=CCH2CH3 と CH3C=CCH2CH3 | | | H H H のように描いて区別しようとしている回答がいくつかあるが、これらはどちらも CH3CH=CHCH2CH3 と同じであり、区別したことにならない。必ず上の解答例のように斜めの結合(棒)を 用いて描くこと。
3.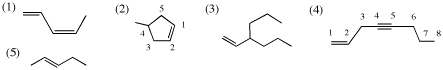
(1) IHD = 2 (2) IHD = 2 (3) IHD = 1 (4) IHD = 3 (5) IHD = 1
4.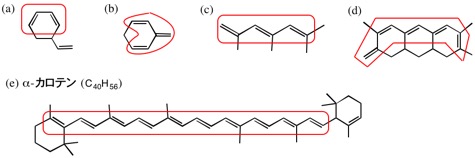
共役二重結合は、長く伸びていても一組である点に注意すること。
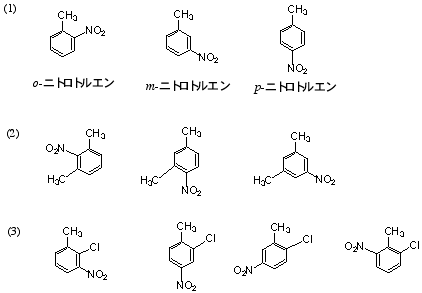
(b) の名前は、4-プロピルトルエン(または1-メチル-4-プロピルベンゼン)が正しい。
6.C9H12のIHD = 4 よりベンゼン環以外に不飽和結合や環はない。
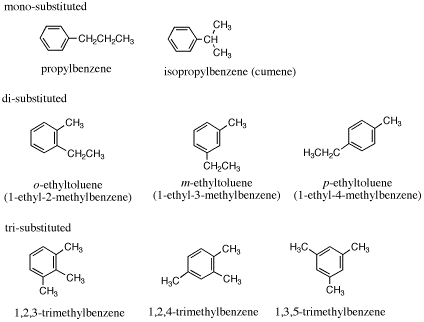
[命名法についての注意]
2置換の場合は、o-エチルトルエンなど(m-、p-)の代わりに2-エチルトルエンなど(3-、4-)でも誤りではない(エチルメチルベンゼンを用いる場合には、アルファベット順で先に来るエチル基の位置番号が小さくなるので1-エチル-2-メチルベンゼンとなり、命名法によって置換基の位置番号が違ってくる)。
1,3,5-trimethylbenzene は慣用名で mesitylene(メシチレン)ともいう。
7.2,4-ペンタジエニルカチオン(陽イオン):CH2=CH-CH=CH-CH2+
2,4-ペンタジエニルアニオン(陰イオン):CH2=CH-CH=CH-CH2-
π電子の非局在化の様子を表す方法の一例。特に指示がなければ左右どちらの方法に基づいていても良い。電荷は、今のところは共役系全体に非局在化すると考えて良い(電荷がどう分布するかは有機化学IIで学ぶ)。
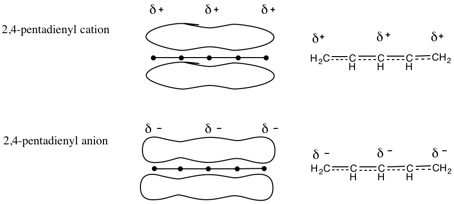
(説明の例)
カチオン(陽イオン)では、4個のπ電子が5つの炭素原子の間に非局在化し、+(正)の電荷はπ電子系全体に非局在化している。
アニオン(陰イオン)では、6個のπ電子が5つの炭素原子の間に非局在化し、-(負)の電荷はπ電子系全体に非局在化している。
(補足)基名の位置番号は、基の付け根(-)の位置が小さくなるようにつける(不飽和結合より優先)。
CH2=CH-CH=CH-CH2-では、右端の-CH2-が1-位になるので、2,4-ペンタジエニル基となる。
上の例のように基名の後に「~カチオン(陽イオン)」や「~アニオン(陰イオン)」をつけてイオンを表すのは慣用名だが、IUPAC命名法(2013年)では許容されている。
陽イオンのIUPAC命名法:中性の基(ラジカル)が電子を1個失って(炭化水素がH-を失って)できる陽イオンの名前は、基名の後に「~イウム(-ium)」をつける。上の例では、2,4-ペンタジエニリウムまたはpenta-2,4-dienylium (2013年)。
陰イオンのIUPAC命名法:中性の基(ラジカル)が電子を1個得て(炭化水素がH+を失って)できる陰イオンの名前は、炭化水素名の語尾に「~イド(-ide)」をつける。上の例では、2,4-ペンタジエニドまたはpenta-2,4-dienide (2013年)。
1.(1) 無極性分子 (2) 極性分子 (4) 無極性分子
(注意)(3) はイオン性物質なので、この分類にはあてはまらない(第2章2.参照)
2.(1) (例)( a) 左上 (b) 右上 (c) 左下 (d) 右下
3.(1) (a) 第一級アミン (c) 第二級アミン
(e) 第四級アンモニウム塩 (f) 第三級アミン
(b) 第二級アルコール (d) 第一級アルコール (g) 第三級アルコール
(2) (f) ((e) も水素結合はできないが、分子性物質ではないので考慮しない)
-->
質問: 「非結合性軌道 nonbonding orbital」とは何か。「反結合性軌道 antibonding orbital」とはどう違うか。
A: Q&Aのページに解答が掲載されています。
質問:命名法の表3の接頭語にしかなれない官能基には、なぜ優先順位がないのですか? Good Question!
A:名前を付ける際に優先順位をつける必要がないからです。規則では、接頭語にしかなれない置換基は、名前を付けるときに基名のアルファベット順に並べるためです。
質問:σMOへの寄与が大きいとはどういうことか。(内容は物理化学)
A: σMOはAOを組み合わせて作られる(2章〜3章)。組み合わせるときに,σMOとのエネルギー差の小さいAOのほうが,σMOの電子雲の形に大きく影響を与えるので「寄与が大きい」という。πMOでも同じ。
質問:可能な水素結合の数を化学式から判断することはできますか。また、判断するのに必要なものはありますか。 Good Question!
A: 分子式では判断できません。構造式なら判断できます。
水素結合の供与体(D)であるHの数と受容体(A)である非共有電子対の数が必要です。
-->
4.(*は「有機化学命名法IUPAC勧告2013(2013勧告)」に基づく推奨名(PIN,Preferred IUPAC Name)。以下同じ。現在、日本化学会は、「従来の1979規則、1993規則、および2013勧告のいずれに従ってもよい」としている。)
(a) 2-プロパンアミン(イソプロピルアミン)、*プロパン-2-アミン
(b) 2-プロパノール、*プロパン-2-オール
(c) N-メチルイソペンチルアミン(N-メチル-3-メチルブチルアミン、N-メチル-3-メチルブタンアミン)、*N,3-ジメチルブタン-1-アミン
(d) 2-メチル-1-プロパノール、*2-メチルプロパン-1-オール
(e) 塩化テトラエチルアンモニウム(tetraethylammonium chloride)、*塩化N,N,N-トリエチルエタンアンモニウム
(f) N,N-ジメチルアニリン、*(同じ)
(g) 2-フェニル-2-プロパノール、*2-フェニルプロパン-2-オール
(a) で「2-プロピルアミン」は誤り。(CH3)2CH-は「1-メチルエチル基」(慣用名は「イソプロピル基」)であり、「2-プロピル基」ではないから。
(b) で「2-プロピルアルコール」「イソプロパノール」は誤り。前者は(a)と同じ理由から。後者は、「イソプロパン」という炭化水素がないから(命名法の誤用)。「イソプロピルアルコール」は慣用名としては正しいが、IUPACは使用を推奨していない。
5.(1)(2)
6.(ポイント)水素結合による会合に言及すること。
7.(1) -1 × (2) 1 (3) 1.5 (4) 5 (5) -0.5 × (6) -1 ×
ただし、アンモニウム塩などのような配位化合物の場合には、IHD が負になる
ことがある。上の場合には次のような例がある。
(1) CH3O+H-CH2CH2CH2O+H-CH3 (5) C6H13-NH3+
これを答えても正解になる。
「構造異性体のまとめ」で説明したように、各化学式と合う構造は多数存在す
る。ここではそのうち一つを答えればいい。解答例はこのファイルの2.を参照。
8.(1) 酸素の質量比(パーセント)を求める。
O: 100-(42.87+2.40+16.66) = 38.07
得られた質量比と原子量(相対質量)とから原子数の比(原子のモル比)を求める。
C: 42.87/12.01 = 3.57
H: 2.40/1.008 = 2.38
N: 16.66/14.01 = 1.19
O: 38.07/16.00 = 2.38
原子数の比を簡単な整数比にするために、まず最も小さなものを1と仮定する。
C: 3.57/1.19 = 3
H: 2.38/1.19 = 2
N: 1
O: 2.38/1.19 = 2
C3H2NO2
もし整数からかけ離れた数字が現れた場合には、それが整数に近づくようにすべてを整数倍する。
(2) 分子式は(C3H2NO2)n となるはず
組成式の式量は12.01×3+1.008×2+14.01+16.00×2 = 84.06
分子量が160~170なので、84.06× n ≒ 160~170。
n = 2のとき 84.06× 2 = 168.12 が条件に合う。分子式は(C3H2NO2)2 = C6H4N2O4
(3) 分子式よりIHD = 6。ベンゼン環はIHD = 4、ニトロ基(-NO2)はIHD = 1に対応する。考えられる構造はジニトロベンゼンの位置異性体(o-、m-、p-)。構造式は このファイルの4.を参照。
-->質問 授業資料中の図.炭素数および水素結合と沸点のRHが、炭素数1~5の範囲で他と比べて沸点の上がり方が急なのはなぜか。Good point!
A: 気体分子運動論(高校物理・化学)によると,同じ温度では分子の平均運動速度(vav)は分子の質量(m)の1/2乗に反比例します(vav ∝ √(1/m) = m-0.5)。分子質量(m)は概ね炭素数と共に直線的に大きくなります。一方,直鎖の炭化水素基では,分子間力は炭素数と共にほぼ直線的に大きくなります。これらのことが沸点に影響を与えている可能性があります。炭化水素(RH)以外の場合には、官能基の存在により分子間力が大きくなるために、炭素数の違いによる上のような効果が緩和され、炭素数に対する沸点の変化が小さくなると考えられます。
質問 水以外の溶液中やイオン液体の中の酸解離定数も同じ定義ですか。Important!
回答:同じです(大きさは異なる)。化学Aで学んだように,Brφnsted(ブレンステッド)の酸・塩基の考え方は,水以外の溶媒中でも成り立ちます。
質問 構造異性体の書き方のコツはありますか? Good Question!
A: 飽和炭化水素を例として記します。まず炭素数から考えられる母核(命名法のときと同じ。直鎖・環)の種類をできるだけ見つけます。そして,各母核について,側鎖(枝分かれ)の位置と種類が異なる構造をできるだけ描きます。最後に,同じ構造が重複していないか検討します。迷ったときは,命名法規則に従って命名します。同じ名前になるものは(当然)同じ構造です(BIOVIA Drawで描いていると容易にチェックできます)。有機化学のページのQ&Aの「結合と構造」(6)もご覧下さい。
-->
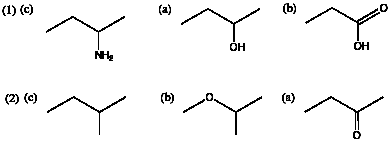
9.(1) (c) < (a) < (b) (2) (c) < (b) < (a)
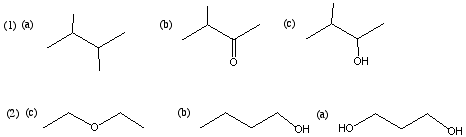
10.(1) (a) < (b) < (c) (2) (c) < (b) < (a)
11.下図の11 を参照。
12.下図の12 を参照。
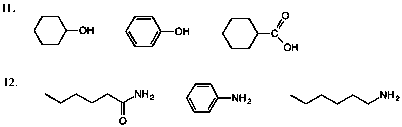
重要:酸性(塩基性)の強さを比較するときは、共役塩基(塩基)の非共有電子対の非局在化の程度を比較する。非局在化しているほど塩基性は弱い(共役酸の酸性は強い)。言葉だけで違いを説明することは難しいので、化学式を示しながら説明するのがよい。
第6章 質問への回答
Q. 配座異性体間の変化(結合の回転、シクロヘキサンの環反転など)を起こすためのエネルギーはどこから得られるのか。
A. 良い質問です。結合の回転が起こるためには、十分な運動エネルギーが分子の一部に与えられる必要があります。これにはいくつかの可能性が考えられます。
一つは、分子のもつ内部エネルギーからです。これは分子内のいろいろな運動エネルギーの総和であり、エネルギーは相互変換できますので、時間と共に運動の様子は変わっています。
もう一つは、外部から分子に与えられるエネルギーです。たとえば、他の分子との衝突により得られるエネルギーが考えられます。液体中や気体中では、分子はたえず他の分子と衝突しており、そのたびに互いにエネルギーをやり取りして、各分子のもつ内部エネルギーは変化しています。
(以下は「物理化学」の内容)
分子のもつ運動には、並進運動(いわゆる分子運動)および分子全体としての回転運動のように分子の形の変化を伴わない運動と、分子内の各結合の振動(伸縮・変角)・回転およびシクロヘキサンのイス形の環反転や窒素の非共有電子対の反転のように分子の形の変化を伴う運動とがあります。単原子分子では並進運動だけを考えれば良いですが、原子数が増えて分子の構造が複雑になるにつれて、多種多様な運動が同時に起こっています。
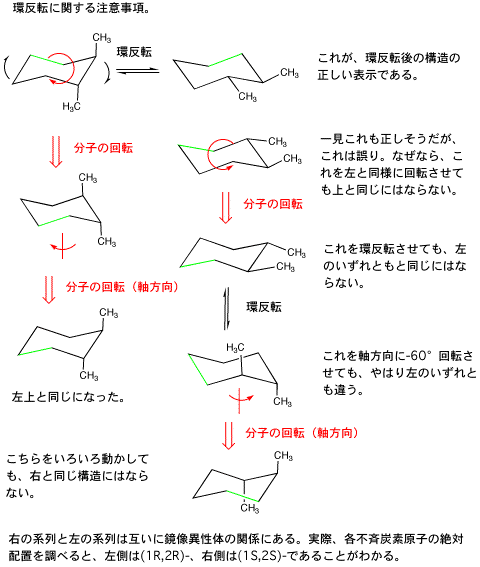
1-ethyl-2-methylcyclohexane などでも事情は同じ。
しかし、cis-1,2-dimethylcyclohexane では事情が異なる。
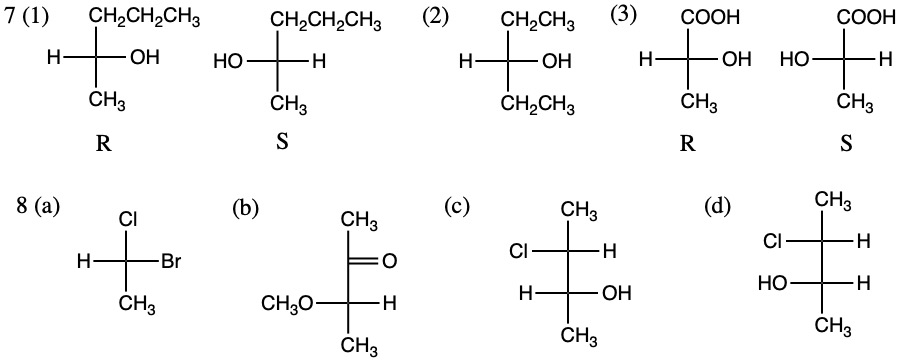
7章 立体化学:立体配置と立体異性体(1)
7.下の(1)~(3) 。(1) (3) はいずれか一方であればよい。8.(2) (a) 下の(4) (b) 下の(5)
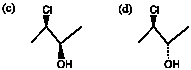
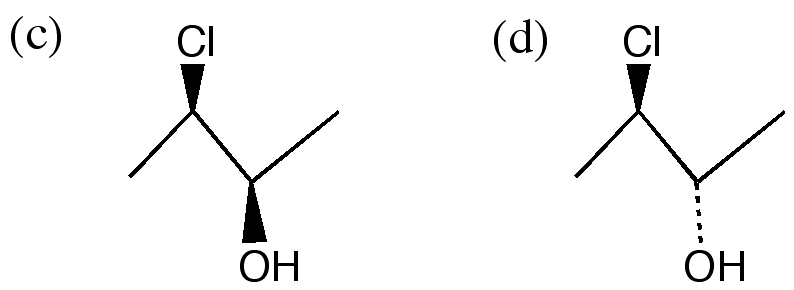
(3) 鏡像の関係ではない(ジアステレオ異性体)。
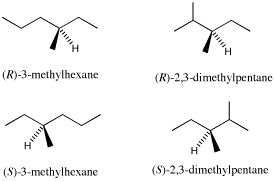
9.下のいずれか。
10.(1) +25.2° (2) -5.04°
注意:量の計算(科学計算)では必ず単位を付けて計算すること。在学中はこれを「あらゆる科目で常に実践しなければならない。」11.
 <--
<--
12. [5]解答例
(1) は1S,3S-体を例示した。1R,3R-体((3)の解答)を用いて回答してもよい。
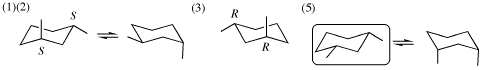
(4) 鏡像異性体
13. 「異性体」を区別する問題では、通常は「立体配座の違い(配座異性体)」は考えない。
構造異性体(位置異性体)のみを考え、立体異性体を区別しなければ4通り。鏡像異性体を区別しなければ(ジアステレオ異性体は区別する)7通り。鏡像異性体を区別すれば9通り。
うっかりすると、環反転による立体配座を区別して描いてしまうことがある(この場合14通りになる)ので注意*すること。
(ポイント)環はいす形。
位置異性体は1,1-、1,2-、1,3-、1,4- 置換体の4通り。
1,2-、1,3-、1,4- 置換体には、それぞれcis形とtrans形の立体異性体(ジアステレオ異性体)がある。
1,2-、1,3- 置換体のtrans形には、それぞれ鏡像異性体がある(cis形はメソ体なので鏡像異性体はない)。
以上が区別されていればいい。
*(注意)trans-1,2-(2種類)、cis-1,3-(1種類)、trans-1,4-(1種類)置換体は、それぞれ環反転を起こすと形の異なる立体配座になる。cis-1,2-置換体が環反転を起こすと、もとの形と鏡像の関係にある立体配座になる。(1,1-、trans-1,3-、cis-1,4- 置換体は、置換基の一方がアキシャル方向、もう一方がエカトリアル方向であり、環反転を起こしても、もとと同じ形になる)。
一つ一つ分子模型を組んで確かめてみよう。 .
10章 有機化学反応の分類と特徴
1.
(1) 置換(縮合) (2) 付加 (3) 脱離 (4) 異性化 (5) 置換
2.(1) (略) (2) 0.50 mol,44 g (3) 61% (4) 50%
2つ以上の反応物が反応に関わる場合に、反応物のモル比が化学反応式の係数の比(「化学量論比」または略して「量論比」という)と異なる場合には、仮に反応が完全に進行したとしても、いずれかの反応物が反応せずに残るはずである。このような場合には、仮に反応が完全に進行した場合には完全に消費されてしまうほうの反応物を基準にして、理論収量を求め、収率を計算する。理由は各自考えてみよ(「背理法」を用いると理由を説明しやすいかも知れない)。矢印は電子の流れる方向を示している。授業に出ていなくて何をすべきかわからなかった人は、テキスト(プリント)10-3,4ページを参照して下さい。これがわからないと先に進めません。
(5)(6)で、カルボニル基の隣(α位)のCHに塩基が接近する件は、「有機化学II」の15章、16章で学びます。今はわからなくても構いません。
10.4 有機化学反応の実例
1-3) 置換反応と脱離反応
1.(1) CH3CH2OCH3 (2) CH3CH2CH2CH2Br (3) (CH3)3COH
methoxyethane 1-bromobutane 2-methyl-2-propanol
求核種:CH3CH2O- Br- OH-
脱離基: I H2O+ (OH) I
注意(重要):CH3CH2OHのC-O結合は、NaOHのNa+-O結合の場合と異なり、共有結合です(しかもC-Cより強い)。OH基は弱い脱離基なので、CH3CH2OHなどからひとりでにOH-が脱離することはありません(だからエタノール水溶液は中性ですし、有害なOH-の生成を心配することなく、成人はこれを飲んでその生理作用を楽しむことができるのです)。C-O結合が切れるのは、(2)のように、酸性条件下でプロトン化してOH2+(=よい脱離基)となり、OH2(水)として脱離する場合がほとんどです。OR基も同じです。
2.(1) CH3COCl + C6H5COO- → CH3COOCOC6H5 + Cl-
(2) C6H5CONHCH2CH3 + H2O → C6H5COOH + CH3CH2NH2
3.(略)正解はいくつもある。授業資料などを参照すること。
4.
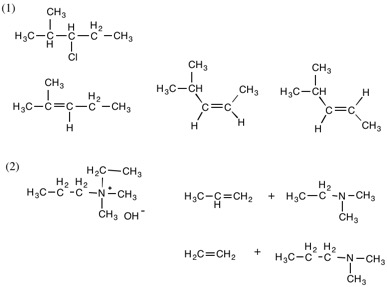
化合物名は不完全。2つの構造異性体が考えられる。どちらであっても回答は同じ。

赤字はβ水素
(質問)よい脱離基とは何か。
A.比較的容易に脱離することのできる脱離基のこと。
具体的には、脱離基をLとすると、脱離して生じる化学種(L-)が安定なものはよい脱離基となる。
一般に、化学種HLの酸性が強いほど、脱離基Lはよい脱離基になる傾向がある。
<--
1.(構造式は略)
(1) bromocyclopentane (2) cis-1,2-dimethylcyclopentane
2.(2)(ポイント)trans付加。生成物はmeso-体なので一つだけであることを、分子模型で確認すること。
(3) (2R,3S)-2,3-dichlorobutane
3.
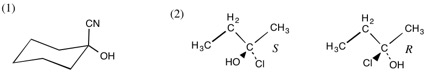
(第14回)
6) ベンゼン環の求電子置換反応1 (略)正解はいくつもある。授業資料などを参照すること。
2