4.不飽和炭化水素
1.
IUPACの1993年および2013年勧告では、1-butene は but-1-ene(ブタ-1-エン)、2-pentene は pent-2-ene(ペンタ-2-エン)のように書いてもいい(海外では1993年以前にも慣用的に使われる場合があった)。しかし、英語綴りと日本語訳とが一致していないためか、国内では普及していない。
注意:E、Z異性体を H | CH3C=CCH2CH3 と CH3C=CCH2CH3 | | | H H H のように描いて区別しようとしている回答がいくつかあるが、これらはどちらも CH3CH=CHCH2CH3 と同じであり、区別したことにならない。必ず上の解答例のように斜めの結合(棒)を 用いて描くこと。
2.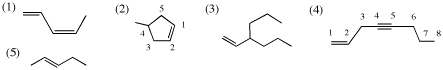
(1) IHD = 2 (2) IHD = 2 (3) IHD = 1 (4) IHD = 3 (5) IHD = 1
3.(1) 略。
(2) (実際に測って3桁目まで報告してほしい。模型でのプラスマイナス1 mm(実際での0.005 nm)程度の誤差は許容する。)
(a) 0.15 nmくらいか。(b) 0.24 nmくらいか。
(c) 最近接の水素原子どうしがもっとも離れたとき以外は、メチル基どうしは互いに反発する可能性が高い。
(3) (例)(Z)-2-ブテンでの(2) (c) に記したようなメチル基どうしの反発は(E)-2-ブテンでは起らないと考えると、(E)-2-ブテンがより安定だと考えられる。
共役二重結合は、長く伸びていても一組である点に注意すること。
5.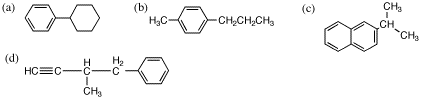
(b) の名前は、4-プロピルトルエン(または1-メチル-4-プロピルベンゼン)が正しい。
6.C9H12のIHD = 4 よりベンゼン環以外に不飽和結合や環はない。
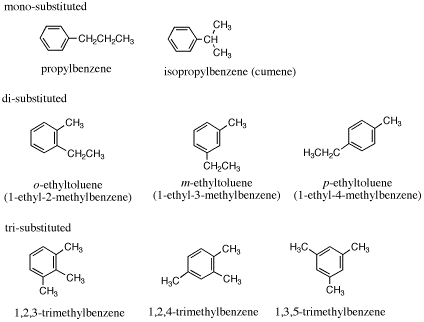
2置換の場合は、o-エチルトルエンなど(m-、p-)の代わりに2-エチルトルエンなど(3-、4-)でも誤りではない(エチルメチルベンゼンを用いる場合には、アルファベット順で先に来るエチル基の位置番号が小さくなるので、命名法によって同じ置換基の位置番号が違ってくる)。
1,3,5-trimethylbenzene は mesitylene(メシチレン)ともいう。
7.2,4-ペンタジエニルカチオン(陽イオン):CH2=CH-CH=CH-CH2+
2,4-ペンタジエニルアニオン(陰イオン):CH2=CH-CH=CH-CH2-
π電子の非局在化の様子を表す方法の一例。特に指示がなければ左右どちらの方法に基づいていても良い。電荷は、今のところは共役系全体に非局在化すると考えて良い(電荷がどう分布するかは有機化学IIで学ぶ)。
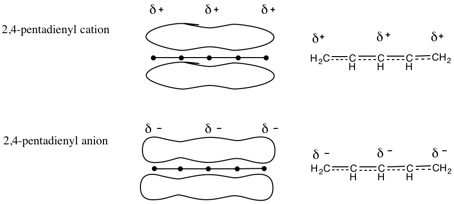
(説明の例)
カチオン(陽イオン)では、4個のπ電子が5つの炭素原子の間に非局在化し、+(正)の電荷はπ電子系全体に非局在化している。
アニオン(陰イオン)では、6個のπ電子が5つの炭素原子の間に非局在化し、-(負)の電荷はπ電子系全体に非局在化している。
(補足)基名の位置番号は、基の付け根(-)の位置が小さくなるようにつける(不飽和結合より優先)。
CH2=CH-CH=CH-CH2-では、右端の-CH2-が1-位になるので、2,4-ペンタジエニル基となる。
上の例のように基名の後に「~カチオン(陽イオン)」や「~アニオン(陰イオン)」をつけてイオンを表すのは慣用名だが、IUPAC命名法(2013年)では許容されている。
陽イオンのIUPAC命名法:中性の基(ラジカル)が電子を1個失って(炭化水素がH-を失って)できる陽イオンの名前は、基名の後に「~イウム(-ium)」をつける。上の例では、2,4-ペンタジエニリウムまたはpenta-2,4-dienylium (2013年)。
陰イオンのIUPAC命名法:中性の基(ラジカル)が電子を1個得て(炭化水素がH+を失って)できる陰イオンの名前は、炭化水素名の語尾に「~イド(-ide)」をつける。上の例では、2,4-ペンタジエニドまたはpenta-2,4-dienide (2013年)。
Q.いくつかの質問への回答
(Q1) どのようなときにE、Zを使い、どのようなときにcis、trans
を使うのか。
(A1) E、Zはどのような場合にも使えます。IUPACの勧告にも沿っていますので、こちらを使うのがいいと思います。cis、trans
を使うときは、注目する置換基(2つ)を指定するのが原則です。ただし、エテンの各炭素の水素原子を一つずつ他の置換基で置換した場合(1,2-二置換アルケン)には、注目する置換基は自明ですので、指定しないで使われます。
(Q2) 次の2つの構造は名前が違うのか?
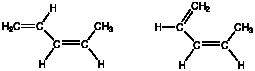
(A2) どちらも同じ構造式を表し、名前は(Z)-1,3-pentadiene で同じです。
ただし、どちらも安定な配座異性体(第6章で学ぶ)であり、形は異なります。(以下はやや発展的内容)配座異性体を区別するときには、左はap
(anti periplanar) 形、右はsp (syn
periplanar) と呼んで区別します(詳しくは、参考文献の欄にある「立体化学」の参考書をご覧下さい)。
(Q3) 有機化合物の炭素原子に結合した水素原子を他の原子に変えたら、形や結合角は変わるのか?
(A3) 単結合は速やかに回転できますが、第6章で学ぶ安定な配座が変わるために、形が変わる場合があります。また、結合の長さや結合角は、最適の長さや角度を基準として、常に振動していますので、分子内の原子の相対的な位置はいつも一定なわけではありません。いいかえれば、(単原子分子以外の)分子は結合の振動や回転のために、常に形を変えているのです。炭素原子に結合している原子が変わると、結合の長さが変わるために、分子内の他の原子とのぶつかり合いが生じ、そのために最適な長さや角度が変わることはよく起こります。
(Q4) IUPAC名はアルファベットで書く方がカタカナよりもいいのか。
(A4) アルファベットで書くのは国際共通の方法である。しかし、IUPACは、各国語の文字や語法を用いて表記することを認めている。したがって、日本語の文章の中ではカタカナや漢字を用いてよい。逆に、国内では、単に英語の綴りをカタカナにしただけの用語は誤りの場合もある。例:○酢酸エチル、×エチルアセテート。○塩化アセチル、×アセチルクロリド。
(Q5) 形式電荷を求めることにより何がわかるか?
(A5) 化学式が与えられた分子やイオンの構造がどうであるか、見当をつけることができる。また、自分で求めた化学式や電荷の数に問題がないかどうかを見極めることができる。