(ポイント)書き方やガイドラインにも記されているが、特に以下の点に十分注意を払っていない回答が目だった。
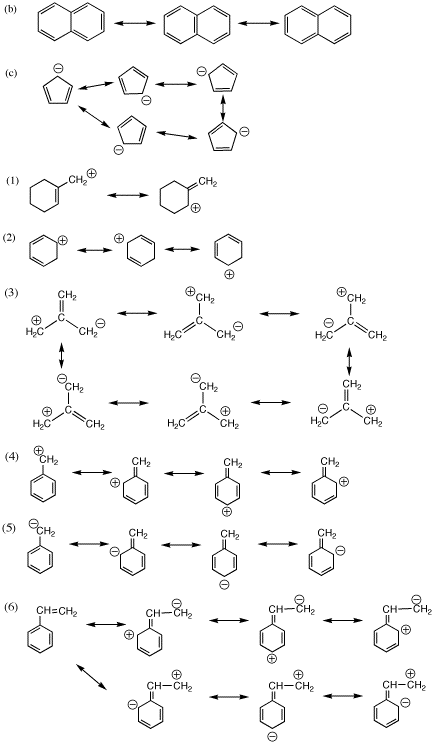
非局在化の式が書けることはこの授業でとても重要ですので、間違えた問題は、いちど下の回答例と見比べて、テキストの例やガイドラインを参照してから、自分でもう一度(見ずに)やり直して、次回に提出して下さい。
すべての問題が解けるようになるまで、何度でも提出することをおすすめします。
1.2.(非局在化の式からわかる実際のπ電子や電荷の分布のようすは、テキストを参考にすれば自分で描けるので省略した。不明の場合はTAなど誰にでも見てもらうと良い。以下同様。)

3.解答はこちら
--4.
理由
1.(ヒント)共役塩基に対するニトロ基の電子求引性誘起効果の影響、距離との関係に言及すること。
2.(ヒント)塩基に対するニトロ基の電子求引性非局在化効果の影響、置換位置との関係および加成性に言及すること。

3.(2) 理由(ヒント)共役塩基の負電荷の非局在化の様子を、非局在化の式などを用いて説明する。
(3) トリフルオロメタンスルホン酸(CF3SO3H)のほうが酸性が強い。
理由(ヒント)F原子の電子求引性誘起効果の影響に言及すること。
重要:酸性(塩基性)の強さを比較するときは、共役塩基(塩基)の非共有電子対の非局在化の程度を比較する。言葉だけで違いを説明することは難しいので、化学式を示しながら説明するのがよい。
1.
(1) 置換(縮合) (2) 付加 (3) 脱離 (4) 異性化 (5) 置換
2.(1) (略) (2) 0.50 mol,44 g (3) 61% (4) 50%
2つ以上の反応物が反応に関わる場合に、反応物のモル比が化学反応式の係数の比(「化学量論比」または略して「量論比」という)と異なる場合には、仮に反応が完全に進行したとしても、いずれかの反応物が反応せずに残るはずである。このような場合には、仮に反応が完全に進行した場合には完全に消費されてしまうほうの反応物を基準にして、理論収量を求め、収率を計算する。理由は各自考えてみよ(「背理法」を用いると理由を説明しやすいかも知れない)。3.
矢印は電子の流れる方向を示している。授業に出ていなくて何をすべきかわからなかった人は、テキスト(プリント)10-6ページを参照して下さい。これがわからないと先に進めません。
(5)(6)で、カルボニル基の隣(α位)のCHに塩基が接近する件は、15章、16章で学びます。今はわからなくても構いません。
4.(1) 求核種 (2) 求核種 (3) 求電子種 (4) 求核種
5.(1) C (2) 発熱反応 (3) Aと最初の遷移状態とのエネルギー差 (4) 反応中間体
6.およそ2.5 〜 e (= 2.72) 倍。
注意:回答が約1前後になった場合などは、指数計算を正しく行っているか、あるいは各物理量の単位を正しく取り扱っているか、もう一度チェックすること。
活性化エネルギーが200 kJ/mol 程度になると、100 ℃付近で温度が10 ℃上がると、反応速度はおよそ2倍程度になるといわれている。正しいかどうか計算して確かめよ。
7.(略)授業資料の例や、参考書に載っているその他の例を用いて説明すると良い。
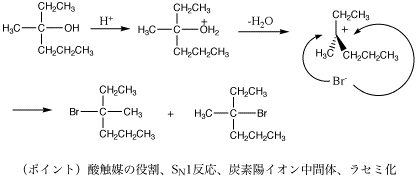
-->1.(1) CH3CH2OCH3 (2) CH3CH2CH2CH2Br (3) (CH3)3COH
methoxyethane 1-bromobutane 2-methyl-2-propanol
注意(重要):CH3CH2OHのC-O結合は、NaOHの場合と異なり、共有結合です(しかもC-Cより強い)。OH基は弱い脱離基なので、CH3CH2OHなどからひとりでにOH-が脱離することはありません(だからエタノール水溶液は中性ですし、有害なOH-の生成を心配することなく、成人はこれを飲んでその生理作用を楽しむことができるのです)。C-O結合が切れるのは、(2)のように、酸性条件下でプロトン化してOH2+(=よい脱離基)となり、OH2(水)として脱離する場合がほとんどです。OR基も同じです。
2.(省略。授業資料や参考書に例がいっくつも書いてあります。)
4.
5.(ヒント)(1) 第一級炭素。よい求核種。
(2) 第一級炭素。よい求核種。-OH基にH+がつくと脱離基として働く。
(3) 第三級炭素、よい脱離基。
以上でわからないときは、授業資料や参考書を参照して考えること。
Q:なぜ相対速度はエチルをもとに考えられているのか? Good Question!
A:もっとも簡単なメチル(CH3-)を基準に用いなかったのは、実験上の困難があるためです。
(1) ブロモメタン(CH3-Br)は室温で気体ですので、溶液中で蒸発による濃度変化を防ぐことが難しい、
(2) ヨードメタン(CH3-I)なら室温で液体ですが、-Iは-Brよりも良い脱離基であるため、
(i) 反応速度が大きすぎて初速度の比較が困難、
(ii) SN1反応が併発している可能性を除外しづらい、
という難点があります。そこで、これらの問題の影響を受けにくいブロモエタンを基準にして多くの実験がされています。
6.演習問題2(1)(2)ヒント:どちらもSN1反応である。
(3) ヒント:アルキル基1個なのでSN2反応である。FとIのうち脱離しやすいのはどちらか?
演習問題3(a) 脱離しやすさの順は?テキスト参照。
(b) ハロゲンが取れた陽イオンC6H5+は安定か?SN2反応で求核種が近づくための空間は空いているか?
演習問題5 構造と反応性の関係。テキストおよび問題3(b) 参照。
解答はこちら。(問題3は上のヒントがわかればわかるので省略)
Chromeで見えないときはこちらへ
1.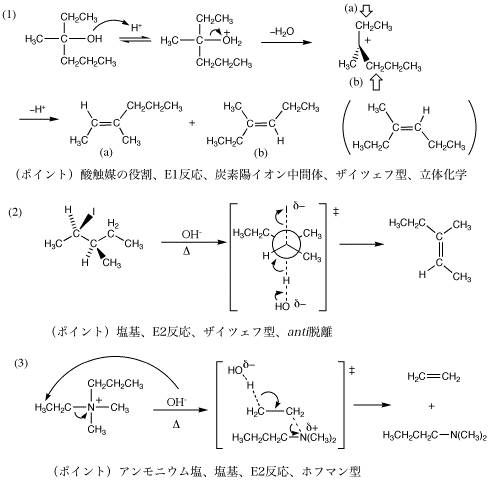
塩基は、立体的にもっとも込み合っていないH−Cに接近して、H+と反応する。
2.ヒント
問題1.(1) 塩基は存在しないのでE1機構。ザイツェフ則に従う。
(2) 塩基が存在するのでE2機構。アンモニウムイオンなのでホフマン則に従う。
問題2.(1)〜(3)は塩基が存在する→E2。(3)は脱離の方向にも注意。
(4) 硫酸がOH基にH+を与えて、よい脱離基が生じる。強酸性下なので塩基は働かない→E1。立体化学にも注意しよう。
解答例はこちら。
問題1.(ヒント)(1)(2)(5) trans付加。(7)ヒドロホウ素化。(8)マルコフニコフ則。
問題3.(1)(ヒント)2-プロパノール、求電子付加、トランス付加、マルコフニコフ則
解答例はこちら(今回の課題以外の解答例も記されているので問題番号に注意してください)
3.の解答例は下のほうの「20. 周辺環状反応」を参照」
1.(ヒント)(a) ニトロニウムイオンの生成経路
(b) ペンタジエニル陽イオン中間体の生成と反応
2.(ヒント)丸暗記は絶対に不可能。まず構造式を描いて考える。活性化基のついたものはどれか?
c, e
3.(a) m-dinitrobenzene (1,3-dinitrobenzene)
(b) 1-(2-methoxyphenyl)ethanone (o-methoxyacetophenone),
1-(4-methoxyphenyl)ethanone (p-methoxyacetophenone)
(c) 2-methylbenzenesulfonic acid (o-toluenesulfonic acid),
4-methylbenzenesulfonic acid (p-toluenesulfonic acid)
(d) 2-bromoethylbenzene, 4-bromoethylbenzene
(e) 2,4-dinitromethylbenzene (2,4-dinitrotoluene), 2,6-dinitromethylbenzene
(2,6-dinitrotoluene)
(f) 4-bromo-2,6-dichloromethoxybenzene (4-bromo-2,6-dichloroanisol)
((a)〜(f)の構造式は下を参照)
(g) 塩化p-トルエンジアゾニウム; 4-methylbenzenediazonium chloride
(h) 4-methoxy-4'-methylazobenzene; 4-(4-methoxyphneylazo)toluene
(i) 4-ヨードメチルベンゼン;4-iodomethylbenzene
((g)〜(i) の構造式は下を参照)
4.(ヒント)問題1 (1)(2)(4)配向性を考える。(5)(6)活性化基が反応位置を決める。
問題7および問題3 置換基による反応性の比較。
問題9 ジアゾニウム塩からのSN1Ar反応。
--1.
(4) (CH3)2CHCH=O + C6H5NHNH2 → (CH3)2CHCH=NNHC6H5 + H2O
2.
3.(ヒント)(1)グリニャール反応 (7) 酸素求核種:アセタールの生成 (11) 第一級窒素の求核種:イミンの生成。 (14) 第二級窒素の求核種:エナミンの生成。 (24) 金属水素化物の反応:水素陰イオンが求核種。
4.ポイント:プロトン化、水の求核攻撃、プロトン移動、アミンの脱離
5.(1) CH3COCl + C6H5COO- → CH3COOCOC6H5 + Cl-
(2) C6H5COOCH3 + 2C6H5MgBr → (C6H5)3COH (または (C6H5)3COMgBr + CH3OMgBr )
6.(ヒント)すべてカルボン酸誘導体の求核付加−脱離反応。
(2) 酸ハロゲン化物と求核種 (5) 酸無水物と求核種 (8) エステルと求核種(OH-) (10)
カルボン酸と求核種の酸触媒下での反応 (18) 酸無水物と求核種
15章 質問への回答
Q1. 問題1.(4)で、Nはプロトン化されないのですか?
A1. いい質問です。確かにこちらも一部はプロトン化されます(酸塩基平衡)。しかし、他の反応経路でプロトン化されていない原料が消費されると、この速い可逆反応はプロトン化とは逆の方向へと進行します。
実際、多くの反応系では、反応の進行とは無関係のいくつもの化学平衡が生じています。カルボニル化合物の反応のような多段階反応の場合はこれが特に顕著であり、反応経路は決して一本道ではありません。自分で反応を考えるときにうまくいかないのは、(a)反応の進行に必要な化学平衡に気がつかない場合(対策:見落としている経路がないか探す)と、(b)反応の進行に無関係な化学平衡にとらわれている場合(対策:袋小路に陥ったら戻って別の経路を進む)とがあります。
迷路を解くのに似ていますが、袋小路にはちゃんと目印があります。それが見分けられるようになれば、反応生成物に到達するのが容易になるでしょう。
1.(1) C6H5COOH(安息香酸)+ CHI3
(2) C6H5-CH(OH)-CH2C(=O)CH3
(下方4.の回答図(4) (5) を参照。)
(3) 2CH3CH2COOCH2CH3 → CH3CH2CO-CH(CH3)COOCH2CH3
+ CH3CH2OH
(クライゼン縮合、-が生成したC−C結合)
2.ポイント:酸性下、エノール体との平衡、ハロゲン分子との反応
(続きは講義資料を参照して自分で完成させよ)
ハロゲン分子は「求電子種」として働く。ハロゲン分子が「酸化剤」として働くのはこの「求電子性」によるものである。。
3.(1) マロン酸ジメチル(MMH)の酸解離定数をK1、メタノールの酸解離定数をK2、反応の平衡定数をKとすると
(2) [MMH]+[MM-] = 1 mol/L, [MeO-] = 1 mol/L - [MM-] = [MMH]
求める濃度([MMH]=[MeO-])をcとすると、
K = [MM-][MeOH]/([MMH][MeO-]) より
Kc2 = [MM-][MeOH]
= (1-c)*31
310c2 + 31c - 31 = 0
10c2 + c - 1 = 0
c = (-1+(12-4*10*(-1))0.5)/20
= (-1+410.5)/20 ≒ 0.27 mol/L 27%
4.(6)から(8)までが(1)〜(3)の回答。
((1)〜(3)は前章の1.(4)および5.(1)(2)の回答)。
5.(ヒント)(3)(15) アルドール反応 (19) 交差アルドール反応 (21)(23) NaBH4による還元ではエステルは還元できない。
1.主生成物
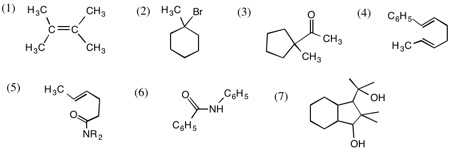
(1) 安定な第三級カルボカチオンが生成するようにCH3基が転位する。
(2) H基が転位すると、安定な第三級カルボカチオンが生成する。
(3) -CH2基のほうが転位する(この場合は、シクロペンタン環のほうがひずみが小さい。CH3基が転位した場合の生成物の分子模型を、sp2混成のCを用いて作るとひずみがわかる)。
(4) [3,3]転位。生成する二重結合のほうが置換基が多く、しかも一方はフェニル基と共役系を生じるので、平衡は生成物側に片寄る。
(5) [3,3]転位。生成物は安定なπ電子系であるアミド結合をもつので、平衡は生成物側に片寄る。
(6) Beckmann転位。C6H5基が転位する。
(7)
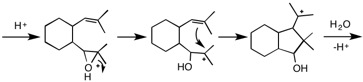
エポキシ環のO原子でプロトン化が起り(1つめ)、安定な第三級カルボカチオン中間体が生じるようにC-O結合が切れ(2つめ)、生成したカルボカチオンが二重結合に接近して、安定な第三級カルボカチオン生じるようにC-C結合が生成する(3つめ)。
2.
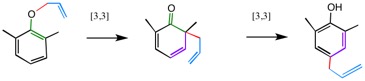
Claisen転位の一種。図では右側で例示したが、どちらのオルト位からでも同じように進行する。矢印の途中には反応中間体はない。中間体ではオルト位に置換基があるため、このままではベンゼン環ができないので、さらにパラ位にまで転位する。
ちなみに、オルト位の片方にだけ置換基がある場合には、置換基のないもう片方のオルト位に転位した生成物が得られる。
3.(下の「20. 周辺環状反応の1.(6)(7)を参照。
1.
2.
4.反応経路は下図の通り。
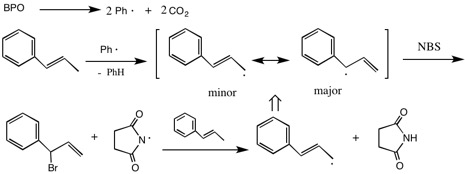
(ヒント)開始剤によって二重結合の隣の炭素からHが引き抜かれる。生成したラジカルは共役系で非局在化するが、ベンゼン環の隣に不対電子のあるほうが安定化が大きいので、寄与(存在確率)が大きいと考えられる。このラジカルがNBSから臭素原子を引き抜くと、Majorなほうの臭素置換体を生じる。
1.どちらの炭素かもわかるように回答すること。
(1) 共に-1 (2) -3と+3 (3) -3と-1
2.テレフタル酸(構造式略)
3.(ヒント)問題1(10) オゾン酸化
解答例は7.の解答と共に掲載
4.
5.演習問題1(3) ヒント 硫酸酸性で6価のクロム化合物(酸化剤)を作用させている。
解答例はこちら。
6(1) CH3CH2CH2CHO + Ag2O → CH3CH2CH2COOH + 2Ag
(アルデヒドの酸化、銀鏡反応)
(2) 2 4CH3COCH2CH2COOCH2CH3
+ NaBH4 + 4H2O → 4CH3CH(OH)CH2CH2COOCH2CH3 + NaOH + B(OH)3
(エステルはNaBH4 では還元されない。NaBH4との反応で生じる塩は
Na+[B(CH3CH(O-)CH2CH2COOCH2CH3)4]
である)
7. 解答例はこちら(問題番号に注意してください)
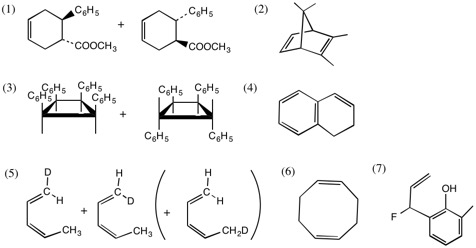
1. 
概説
(1) Dies-Alder反応。cis付加。生成物は鏡像異性体。
(2) Dies-Alder反応。cis付加。
13章の範囲はここまで。
(3) 光による[2+2]環化付加。cis付加。生成物はどちらもアキラルだが、互いにジアステレオ異性体。
(4) 6π電子系の電子環状反応。ベンゼン環ができるので進行しやすい。
(5) H(D)原子の[1,5]シグマトロピー転位。Dが最初に転位した場合には、生成物は見かけ上、原料と同じ。
17章の範囲はここから。
(6) [3,3]シグマトロピー転位の一種、Cope転位。4員環のひずみが解消される。
(7) [3,3]シグマトロピー転位の一種、Claisen転位。メチル基のない側に転位し、エノール体への互変異性によりフェノール類になる。Fの位置に注意。「19. 転位反応と環化反応」2.の解説を参照。