<解答上の注意>
一部の記号は国際的な慣習に従うために,高校の教科書等とは異なった表現となっている場合がありますので注意して下さい.
(例)1 L(リットル)=1×103 cm3
kJ mol-1 = kJ / mol
mol L-1 = mol / L など
中心原子のAの回りにn個の原子が配置されている分子またはイオンABnm+ は原子の種類,電荷によりさまざまな構造をとるが,「等電子性」を利用すると構造の予測が容易になる.ここでBは2種類以上の原子であってもかまわない.なお,文中にでてくるXeはキセノン(希ガス元素の一つ)で,この考え方では価電子数は最外殻電子数と同じ8とする.
CH4,NH4+,BH4-は等しい数の電子と等しい数の原子をもっている.この三つの分子,イオンはどれも正四面体の構造をもっている.このような関係を等電子・等構造とよび,化合物の構造を知る上で重要な鍵となる.SiH4の構造も正四面体である.電子の総数はCH4とは異なるが価電子の数は等しく,構造を決めているのは価電子であって,内殻の電子は関与しないことがわかる.総電子数は異なっても,価電子数が同じものは等電子と考えてよい.
逆に,等しい数の原子からできている分子でも,価電子の数が異なれば構造が異なる.例えば,CF4は正四面体,SF4はシーソー形,XeF4は平面四角形である.(この図において,結合を表すくさびは,太い末端についた原子が細い末端にある原子より手前にあることを示している.)
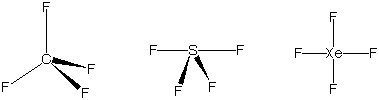
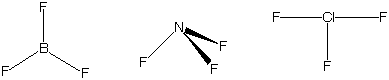
同様にBF3,NF3,ClF3分子も価電子数が異なるため異なる構造をもっている.すなわち,BF3は平面三角形,NF3は三角錐,ClF3はT字形の構造をもつ.
これらをもとに以下の問に答えよ.なお,等電子・等構造の考え方は,ABnm+のような単純な分子・イオンだけでなく,問5,6に示すような複雑な分子にも拡張できる.
問1. IF4- イオンとPF4- イオンの構造を,それぞれ等電子の関係から予測せよ.
問2. SO42- と等電子・等構造の中性分子および1価の陰イオンを1種類ずつ挙げよ.
問3. CO32- イオン,SOF2(Sが中心原子)分子の構造を等電子・等構造の考え方から予測せよ.
問4. CH4とCF4はどちらも正四面体構造をもっている.CH2OとCCl2Oはともに平面三角形の構造をもっている.このような分子の組み合わせは等電子・等構造と考えてよいだろうか.理由とともに述べよ.
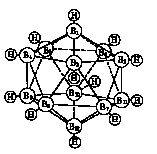
問5. B6H62- イオンは正八面体の骨格をもち,ホウ素−水素結合は各頂点にあるホウ素原子から放射状に伸びている.BH- イオンはCHと等電子であるため,中性分子B4C2H6の骨格B4C2もB6H62- イオンと同じ八面体である. B4C2H6には炭素の占める位置により異性体が存在するが,全部で何種類の異性体が期待できるか.
問6. B12H122- イオンは正二十面体の骨格をもっている.中性分子B10C2H12の骨格B10C2もB12H122- イオンと同じ二十面体である.
(1) B10C2H12には炭素の占める位置により異性体が存在するが,全部で何種類の異性体が期待できるか.
(2) 正二十面体骨格の原子の位置の番号は下図のように決められている.それぞれの異性体の炭素の位置を番号で示せ.ただし,炭素原子の番号がなるべく小さくなるようにするものとする.
(3) それぞれの異性体について,極性の有無を記せ.
ベンゼン(C6H6)を原料にしてニトロベンゼン(C6H5NO2)を生成させた後,還元してアニリン(C6H5NH2)を合成した.
このアニリンに含まれる不純物を取り除くためアニリンを蒸留する方法を考えた.しかし,アニリンの沸点は184 ℃と高すぎるため,図1のような装置を用い,100 ℃以下で蒸留できる水蒸気蒸留を行うことにした.
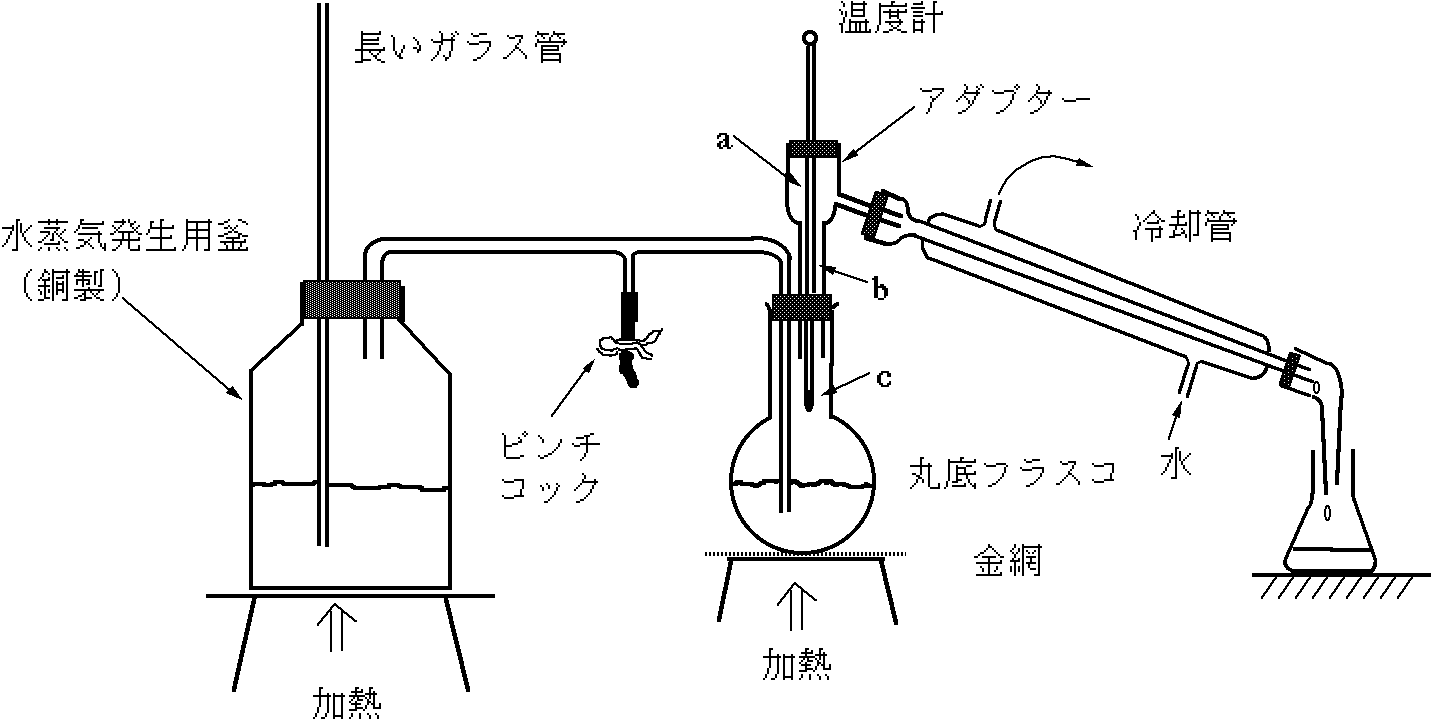
図1.水蒸気蒸留装置の概略図
水蒸気蒸留の原理は以下のとおりである.
水に不溶な有機物を混ぜた不均一な混合物の全蒸気圧Pは,有機物の蒸気圧P1と水の蒸気圧Pwの和であり,次の式(1)が成り立つ.
P = P1 + Pw ……(1)
全蒸気圧Pが大気圧以上になれば混合物は沸騰する.そのため,100 ℃以下の温度でもこの有機物を蒸留できる.
さらに,留出液は水と有機物の混合物であるが,この時の有機物の物質量をn1 mol,水の物質量をnw molとすれば,留出液中の物質量の比は,次の(2)の式になる.
n1 / nw =〔 〕……(2)
そして,留出液中の有機物の質量をW1,水の質量をWw,有機物の分子量をM1,水の分子量をMwとすれば,この留出液中の質量比は(3)式になる.
W1 / Ww =〔 〕……(3)
そこで,水蒸気蒸留法でアニリンを約98 ℃(P1 = 7.02 kPa, Pw = 94.3 kPa)で留出させた.図2の蒸気圧曲線を参考にして,次の各問に答えよ.
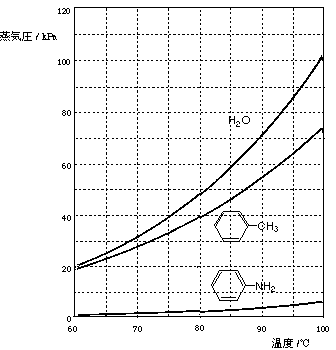
図2.蒸気圧曲線
問1. 温度計の先端(感熱部)はa〜cのどの位置とするのがよいか.a〜cの記号で答えよ.また,その理由を簡潔に記せ.
問2. 水蒸気発生用の銅製容器の長いガラス管は,何のために用いられているか.その理由を簡潔に記せ.
問3. (2)式の右辺の空欄を,P1とPwで示せ.
問4. (3)式の右辺の空欄を,P1, Pw, M1, Mwで示せ.
問5. アニリンはトルエン(C6H5CH3,沸点110 ℃)に比べ沸点が高い.その理由を,分子構造の観点から説明せよ.
問6. トルエンと水の混合物の蒸気圧曲線のグラフを描き,沸点を推定せよ.
次の文章を読んで各問に答えよ.
A ケイ砂(主に石英SiO2からなる)を水酸化ナトリウムと一緒に融解するとケイ酸ナトリウムが生じ,その濃厚水溶液は水ガラスとして知られている.水ガラスに酸を加えるとゲル状のケイ酸が生じ,これを洗浄,乾燥するとシリカゲル(SiO2・nH2O)になる.シリカゲルは非晶質の固体だが,石英は結晶で,純粋なSiO2からなっている.
ケイ酸塩やSiO2の構造を考えるときは,図1aに示すSiO4四面体を構造単位として考えるとよい.例えばケイ酸ナトリウムにはいろいろな組成のものが知られ,その中でNa4SiO4(2Na2O・SiO2とも書ける)という物質は [SiO4]4- の独立した単位を持っていると考えることができる.一方,二酸化ケイ素SiO2はSiO4四面体の4個の酸素がすべて共有され,巨大分子を形成している(図1b).これらケイ酸塩から二酸化ケイ素にいたる物質群にはさまざまな構造のものが知られ,構造はO/Si比の値で整理できる.O/Si比は上記のNa4SiO4では4,SiO2では2となる.
a)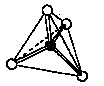 b)
b)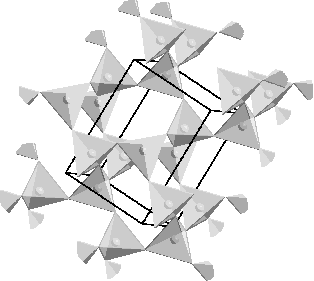
図1 a) ケイ素と酸素からなるSiO4四面体,b) SiO2の構造模式図
問1. シリカゲルは乾燥剤に利用されるが,石英は乾燥剤に使えない.どうしてこのような違いがあるのだろうか.その理由を記せ.
問2. SiO4四面体が連結して図2のようなシート(層)が積み重なった層状構造のケイ酸塩がある.そのO/Si比はいくつになるか.ただし,層はSiO4四面体が層平面の方向に無限につながり,また層と層の間には陽イオンが存在し,層同士は結合していないとする.

図2. 層状のケイ酸塩構造の一例
B 衣料用合成洗剤は,界面活性剤の他にもいろいろな物質を含む.そのうち,硬水(Ca2+, Mg2+ が比較的多く溶解している水)を軟化する(Ca2+, Mg2+ を取り除く)役目を担うのが,ゼオライトと呼ばれるケイ酸塩である.ゼオライトは微細な空孔(ミクロ孔)を規則正しくもつ結晶性の物質である.
ゼオライトの骨格はSiO4四面体がつながってできており,構造中のSi4+の一部をAl3+に置き換えることができるので,主にSi−O−Si結合,Si−O−Al結合が構造内に存在する.ゼオライトの構造を考える場合,次のような構造ユニットを考えるとわかりやすい.まず図3に,Si−O−Si結合,Si−O−Al結合の表示と,その略式表示を示す.図3aではSiO4(あるいはAlO4)四面体が6個,図3bでは4個が縮合した環状ユニットを表している.図3c,dにはその略式表示を示す.これらの図で線は−O−を表し,頂点はSiまたはAlを表している.例えば,SiO4四面体4個が縮合した環状ユニットが八面体の各頂点に存在し(図4a),それらが互いに結合していれば図4bになる.図4bに示されている6角形の面をR面,4角形の面をS面とここでは呼ぶ.図4cは線と頂点の表示を,Al, Si, Oの位置がわかる形で書き直したものである.図4b,cで示されたかご状のユニットをソーダライトユニットと呼ぶ.
ソーダライトユニットのS面が互いにSi−O−Si(またはSi−O−Al)結合を介して連結すると,ゼオライトの一つ「ゼオライトA」の骨格となる.図5aに,ゼオライトAの結晶構造の骨格を示す.組成はNa12[(AlO2)12(SiO2)12]・27H2Oである(この場合Si/Al比は1となる).図の太線で示した「窓(開口部)」の直径は4×10-8 cm程度である.この物質では結晶構造内でSi4+の半分がAl3+に置き換わっている.ミクロ孔内の水は脱水することができ,そのとき構造は保持され,ふたたび水を吸着できる.
Si4+の一部がAl3+に置き換わると骨格構造は全体として負に帯電し,電荷のバランスをとるために,陽イオンが構造内のミクロ孔に存在している.ミクロ孔内の陽イオンはイオン交換樹脂と同じように交換性がある.ミクロ孔内に陽イオンMn+が存在するとき,M型ゼオライトと呼ぶ.
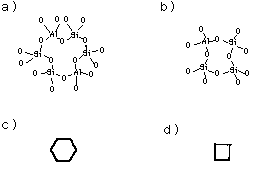
図3. 結合の表示法 a) 4個のSiと2個のAlを含む6個の環状ユニット,b) 4個の環状ユニット,c) aの略式表示,d) bの略式表示
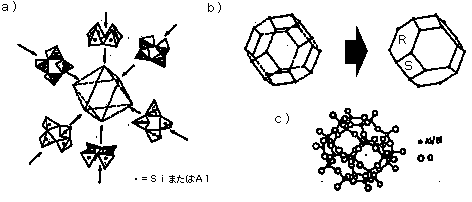
図4. a) 4個の環状ユニットが八面体の頂点に存在するイメージ図,b) ソーダライトユニットを切頭八面体として表示,c) かご状のユニット(ソーダライトユニット)
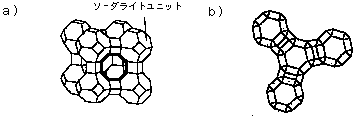
図5. a) ゼオライトAの骨格 b) R面を連結させた4個のソーダライトユニット
問3. 上で述べたように,ゼオライトAの構造は,ソーダライトユニットのS面が互いに連結し骨格を形成している.「窓(開口部)」は8個のSiO4(あるいはAlO4)四面体で囲まれている.もしソーダライトユニットのR面が互いにSi-O-Si(あるいはSi-O-Al)結合を介して連結して骨格を形成したとすると,ゼオライトAとは異なる骨格が形成できる. 図5bには四つのユニットが連結した形を示してある.そのとき生成するゼオライトの「窓(開口部)」は何個のSiO4(あるいはAlO4)四面体で囲まれているか.
問4. Si/Al比が2と3の二種類のNa型ゼオライトがある.これらを同じ質量ずつ用いた時,どちらがより多くのカルシウムイオンを除けるか.理由とともに述べよ.
問5. ミクロ孔内に水素イオンをもつゼオライト(H型ゼオライト)は酸触媒として用いられる.H型ゼオライトはどのように調製すればよいのだろうか.一つはM型ゼオライトを(A)で処理し,乾燥する方法がある.しかし(A)で処理すると構造が崩れるものもあり,その場合はM型ゼオライトに(B)を作用させた後,加熱して揮発性成分を除くことによって得ることができる.(A),(B)に適合する物質を記せ.
酸素原子の酸化数は -2〜0であるが,硫黄原子は酸素原子よりも多様な酸化数をとる.
チオ硫酸イオンS2O32- および四チオン酸イオンS4O62- の模式的な構造を式(1)のように表す.ここで,S2O32- イオン中の2個の硫黄原子の酸化数は互いに異なっている.また,S4O62- イオン中には酸化数の異なる2種類の硫黄原子が2個ずつ存在している.
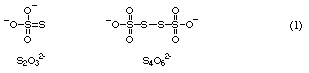
問1. S2O32- とS4O62- のイオン中にはどちらも酸化数の異なる2種類の硫黄原子が存在している.両者ともそのうちの1種類の硫黄原子の酸化数が硫酸イオン中の硫黄原子の酸化数と同じであるとすると,S2O32- とS4O62- のイオンのもう1種類の硫黄原子の酸化数はそれぞれいくらか.
チオ硫酸ナトリウム水溶液にヨウ素を加えると,次式のように反応して四チオン酸イオンを生成する.
![]()
濃度不明の酸化剤の定量に,ヨウ素とチオ硫酸ナトリウムの酸化還元反応[式(2)]を利用した酸化還元滴定を,特にヨウ素滴定と呼ぶ.
チオ硫酸ナトリウム水溶液に酸を加えると亜硫酸イオンと硫黄を生じる.
![]()
チオ硫酸ナトリウム水溶液が空気中の二酸化炭素を吸収すると溶液はやや酸性になる.すると, 式(3)の反応が進行し,チオ硫酸イオンの濃度が変化してしまう.これを防ぐため,酸化還元滴定に用いるチオ硫酸ナトリウム水溶液には少量の炭酸ナトリウムを加えておく.
問2. チオ硫酸ナトリウム水溶液に加えた炭酸ナトリウムは,空気中の二酸化炭素と反応する.この反応を化学反応式で答えよ.
ヨウ素滴定によって,市販のオキシドール中の過酸化水素の濃度を求めた.
[操作1]チオ硫酸ナトリウム五水和物の結晶13 gに炭酸ナトリウム十水和物0.1 gを加え,水を加えて1 Lとして,約 0.05 mol L-1チオ硫酸ナトリウム水溶液を調製した.
[操作2](ア)三角フラスコに1 mol L-1ヨウ化カリウム水溶液 5 mLと1 mol L-1硫酸 5 mLをとった.さらに 0.0102 mol L-1過マンガン酸カリウム水溶液をホールピペットで10.0 mLとって加えたところ,水溶液の色は褐色に変化した.
この水溶液に,ビュレットから操作1で調製したチオ硫酸ナトリウム水溶液を滴下した.チオ硫酸ナトリウム水溶液の滴下によって溶液の色は次第にうすくなり黄色の水溶液となった.このとき1%デンプン溶液を4滴加えると,水溶液は青色を呈した.さらにビュレットからチオ硫酸ナトリウム水溶液を加え,水溶液の青色が無色になった点を反応の終点とした.滴下したチオ硫酸ナトリウム水溶液の体積は 10.0 mLであった.
[操作3]市販のオキシドール10.0 mLをホールピペットではかりとり,250 mLメスフラスコに入れて水を加え,正確に25倍にうすめた.
(イ)三角フラスコにうすめたオキシドールをホールピペットで10.0 mLとり,
さらに1 mol L-1ヨウ化カリウム水溶液5 mLと1 mol L-1硫酸5 mLを加えた.
次に,ビュレットから操作1で調製したチオ硫酸ナトリウム水溶液を滴下した.水溶液の色がうすい黄色になってから1%デンプン溶液を4滴加え,水溶液の青色が無色になるまで,さらにチオ硫酸ナトリウム水溶液を加えた.滴下したチオ硫酸ナトリウム水溶液の体積は13.8 mLであった.
また,ホールピペットでとった市販のオキシドール10.0 mLの質量を測定したところ,10.1 gであった.
問3. ヨウ素滴定の操作[操作2および操作3]では1 mol L-1 硫酸のかわりに2 mol L-1 塩酸を用いて実験を行っても支障がない.その理由を答えよ.
問4. 操作2の下線(ア)の過マンガン酸カリウムとヨウ化カリウムの反応をイオン反応式で示せ.
問5. 操作3の下線(イ)のオキシドール(過酸化水素)とヨウ化カリウムの反応をイオン反応式で示せ.
問6. 上の酸化還元滴定の結果より市販のオキシドール中の過酸化水素の質量パーセント濃度を有効数字3桁で求めよ.分子量 H2O2 = 34.0 とする.解答にあたっては,根拠となる計算の過程を示すこと.
表1には,枝分かれのない飽和炭化水素(アルカン)の名称,その炭素原子のつながりを表す簡略化した構造式,および沸点を示してある.
表1
|
炭素数 |
名称 |
簡略化した構造式 |
沸点(℃) |
|
1 |
メタン |
|
-161 |
|
2 |
エタン |
|
-87 |
|
3 |
プロパン |
|
-42 |
|
4 |
ブタン |
|
-1 |
|
5 |
ペンタン |
|
( ) |
|
6 |
ヘキサン |
|
69 |
|
7 |
ヘプタン |
|
98 |
ブタンより大きなアルカンには,炭素原子のつながり方の違う構造異性体が存在する.ヘキサンまでのすべての異性体を表2に示してある.
表2
|
炭素数 |
名称 |
簡略化した構造式 |
沸点(℃) |
|
4 |
2-メチルプロパン |
|
-12 |
|
5 |
2-メチルブタン |
|
28 |
|
5 |
2,2-ジメチルプロパン |
|
10 |
|
6 |
2-メチルペンタン |
|
60 |
|
6 |
3-メチルペンタン |
|
63 |
|
6 |
2,2-ジメチルブタン |
|
50 |
|
6 |
2,3-ジメチルブタン |
|
58 |
化合物の名称を表すための数を意味する接頭語,モノ(1),ジ(2),トリ(3)などがわかると,これらの炭化水素の化学的な名称と構造の関係が理解されるであろう(表2の下線に注意).なお「モノ」は省略されることが多い.以上のことをもとにして,以下の問いに答えよ.
問1. 枝分かれのないアルカンの沸点は,炭素数の増加に対しておよそどのような変化をするといえるか.
問2. アルカンの異性体の沸点は,その構造とどのような関係にあると考えられるか.
問3. ペンタンの沸点をできるだけ正確に予測せよ.有効数字は二桁とせよ.
問4. ヘプタンの異性体は,表1に示したものの他にどのようなものがあるか.簡略化した構造式を用いてすべて描け.
問5. 炭素原子に結合している4つの原子または原子団がすべて異なるとき,この炭素原子を不斉炭素原子という.ヘプタンの異性体の中に2種類だけ不斉炭素原子を持つものがある.その簡略化した構造式を描き,不斉炭素原子に*印を付けよ.またその分子の名称も書け.
未知の有機化合物の構造はさまざまな情報を総合して決定される.以下の文章を読み,各問に答えよ.なお,有機化合物の構造式は,下の例のように炭素原子および水素原子を省略して示してある.また,原子量はH = 1.0,C = 12.0,O = 16.0とせよ.
問1. オレンジの皮の成分として,炭素と水素だけからなる化合物Aが得られた.このAをある量はかりとって,完全に燃焼させたところ,二酸化炭素 10.08 mg,水 3.33 mg が得られた.また,分子量の測定値は138 ± 3であった.下に示す炭素数10からなる化合物群1−9のうち,このデータと矛盾しないものを選び,番号で答えよ.
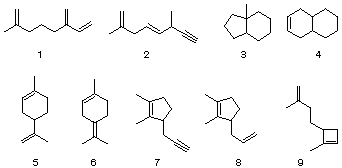
問2. 化合物A 25.0 mg に水素を付加させたところ,8.2 mLの水素を吸収し,飽和化合物Bを生じた(ただし,1モルの水素は22.4 Lであるとせよ).問1の解答のうちで,このデータと矛盾しないものはどれか.
問3. アルケンを過マンガン酸塩と反応させると,二重結合が開裂し,二つのカルボニル化合物を生じる.たとえば,2-メチル-2-ブテンを反応させると式(a)のようにアセトンとアセトアルデヒドが生じ,後者はさらに酸化されて酢酸となる.
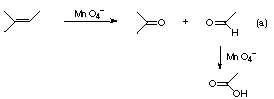
さて,化合物Aを過マンガン酸塩と反応させたところ,生成物の一つとして化合物Cが得られた.問2の解答のうちで,この実験事実と矛盾しないものはどれか.
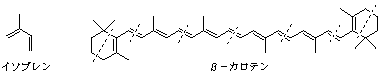
問4. 植物に含まれる天然の化合物の中には,炭素数5のイソプレンと同じ炭素原子骨格が複数結合した構造のものが多くみられ,化合物の構造決定にはよい手がかりとなる(ただし,二重結合の数と位置は関係ない).これをイソプレン則と呼ぶ.例えば,β−カロテンは8つのイソプレン単位からなると見なすことができる.問3の解答の中にこのイソプレン則にしたがった構造のものがあれば,番号で答えよ.ない場合には,なしと記入せよ.
日本化学会・化学教育協議会・平成11年度高校化学グランプリ小委員会(委員長:渡辺 正)
(ページ管理責任者:伊藤眞人:itomasa@t.soka.ac.jp)