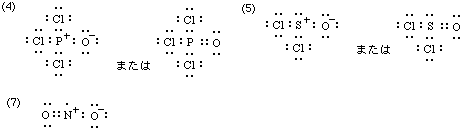
(4)(5)の左側および(7)は形式電荷の記入が必要(もちろん(3)(6)も)。(4)(5)の右側は、d軌道関与(反オクテット則)を考える場合。(8)〜(10)はd軌道関与を考えないと描けない。
(6)の構造式は「有機化学I」の講義資料を、(9)(10)の構造は竹内「化学の基礎」第4章を参照のこと。
無機化学演習 問題の解答例
教科書の問題は巻末の解答を参照すること。
第2回
1.(2) 理解を深めるには、誤答の例が参考になることも多い。
元素?
一番上の例は、酸素原子(O)または酸素分子(O2)の場合の2通りが考えられる。前者の場合は「単体」の意味でもない。
一番下の例は、「元素」と考えても意味は通るが、ほとんどの場合は「単体」の意味で使っているだろう。この後に、「また、水蒸気と二酸化炭素も含まれる。」と続けば、間違いなく「単体」の意味である。
単体?
二番目の例に関連して、「オゾンは、酸素に紫外線を照射するとできる。」という文中の「酸素」は「単体」の意味である。しかし、このことを念頭に置いて二番目の文を書くことはありそうもない。
三番目の文について考えてみよう。次の文は紛らわしいが、その中には「元素」としての酸素と「単体」としての酸素の両方が正しく用いられている。
酸素の単体には酸素とオゾンがある。
1.略
2.(1) (2) 略
(3) たとえばψ= a sin (2π/λ)x 図は略。
(4) λ= 2b/n 図は略。
1.(1) n = 3, l = 2, ml = -2, -1, 0, 1,
2.
(2) n = 4, l = 1, ml = -1, 0, 1.
(3) n = 4, l = 3, ml = -3, -2, -1, 0, 1,
2, 3.
(4) n = 5, l = 2, ml = -2, -1, 0, 1, 2.
2.(略解)(1) [Ar] 3d6 4s2
(2) [Ar] 3d1 4s2
(3) [Kr] 4d10 5s2 5p5
(4) [Ar] 3d5
(5) [Xe] 4f14 5d8
3.(1) Fe2+. (2) V (3) Cr3+
注:イオンになるときは、最外殻から順に電子がとれる。そのため、d軌道に電子の多い遷移金属は2価の陽イオンになりやすい。
1.(1)(ヒント)Cuの電子配置は[18Ar] 3d10 4s1、Agの電子配置は[36Kr] 4d10 5s1である。注意:いわゆる「閉殻」ではない。
(2) [86Rn] 5f14 6d10
7s1または[86Rn] 5f14 6d9
7s2。第11族。
(解説)一般則の通りだと6d9 7s2、問(1)の他の11族元素から類推すると6d10
7s1。実験データはまだ明らかになっていない。
(3) Uut:[86Rn] 5f14 6d10 7s2 7p1なので第13族。
Uuo:[86Rn] 5f14 6d10 7s2 7p6 なので第18族。
2.計算すると2.66程度になるはず(教科書の解答は表1.13の値と同じ)。
3.(1) N, (2) O, (3) C, (4) O, (5) Br, (6)Cl. 5-4-1-2-6-3
4.もっとも大きいもの:S2- もっとも小さいもの:Ca2+
(ヒント)電子数は同じ。(有効)核電荷は?
1.(a) 分子性 (b) 高分子 (c) イオン性 (d) イオン性(高分子) (e) 分子性 (f) 高分子 (g) 金属 (h) 分子性 (j) イオン性 (k) イオン性 (l) イオン性 (m) 分子性 (n) 金属
1.Lewis式(間違いの多かったもの)

(4)(5)の左側および(7)は形式電荷の記入が必要(もちろん(3)(6)も)。(4)(5)の右側は、d軌道関与(反オクテット則)を考える場合。(8)〜(10)はd軌道関与を考えないと描けない。
(6)の構造式は「有機化学I」の講義資料を、(9)(10)の構造は竹内「化学の基礎」第4章を参照のこと。
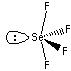 形:(1) 四面体または三角錐 (2) 折れ線 (3) 正四面体 (4) 四面体(三角錐) (5)
四面体(三角錐) (6) 四面体(三角錐) (7) 折れ線 (8) 右図の通り(三角両錐、シーソー形も可) (9) 三角両錐 (10)
正八面体
形:(1) 四面体または三角錐 (2) 折れ線 (3) 正四面体 (4) 四面体(三角錐) (5)
四面体(三角錐) (6) 四面体(三角錐) (7) 折れ線 (8) 右図の通り(三角両錐、シーソー形も可) (9) 三角両錐 (10)
正八面体
2.(めやす)室温で安定な結合のエネルギーは概ね 102〜103 kJ mol-1 の範囲。
クーロンポテンシャルエネルギーなので、Madelungの式(47ページの(2.4)式)を用いればよい。この値はイオン1個あたりなので、上の 10-24 倍程度の値(10-18〜10-19 J)である。指数の計算と単位換算を間違えないように。Z+、Z-はそれぞれいくつか?
-1.43 × 10-18 J
これを1 molあたりに換算した -8.59×105 J mol-1 (
-859 kJ mol-1)も正解。
Born-Landeの式で格子エネルギーを求めた 7.53×105 J mol-1
(+, - の符号に注意)も今回は一応正解とするが、試験では減点対象となるので注意すること。
単位の記載のないもの、格子エネルギーの回答でJのみのものが目立った。単位がなければ、物理量の大きさを答えたことにならない点を心すべきである。
3.(めやす)室温で安定な結合のエネルギーは概ね 102〜103 kJ mol-1 の範囲。
Born指数 n = 8.5 として計算すると738 kJ mol-1くらいになる(教科書の表の計算値や解答とは一致しない)。
イオンのクーロン力やそのポテンシャルの計算には、e2/(4πεo) = 2.306 x 10-28 Jm や、 NAe2/(4πεo) = 1.389 x 10-4 Jm mol-1が必ず用いられるので、控えておくと計算が楽になる。
1.(ヒント)水素結合の有無と強さ。
2.
1.(注意)六方最密格子については、単位格子に着目しているわけではない。
2.(めやす)簡単なイオン結晶の場合、イオン半径(0.1 nm 前後)よりは大きいがその10倍程度(10 nm)を超えることはめったにない(大きな分子からなる分子結晶の単位格子はこれより大きい)。
3.(めやす)分子結晶、イオン結晶、共有結合結晶では概ね1 g cm-3の台、金属結晶では小さいものでは1 g cm-3前後から、大きいものでは20 g cm-3を超えるものもある。
1.2.赤が酸、青が塩基(イオンの価数は省略)。下線のほうが柔らかい。
(1) 2AgF + CaBr2 → 2AgBr + CaF2
(2) ZnCl2 + CaS → ZnS + CaCl2
(3) Cu(OH)2 + NaI → CuI + 2NaOH
3.ここを参照。
2.ここを参照。
1. 10.5 0.30 V 10.6 6.86 g
2.(1) 左が正極、右が負極。0.0089 V。
(2) (ヒント)どちらの極も反応に関わる物質は同じ。
(3) (考え方)回路が閉じて電気が流れ続けるためには、(a) 正電荷をもった亜鉛イオンが右室から左室に移動するか、(b) 負電荷を持った硫酸イオンが左室から右室に移動する必要がある。(a) は濃度勾配と逆なので自然には起こらない。それどころか、逆に左室から右室へと拡散移動するので都合が悪い。したがって、亜鉛イオンの拡散移動を防ぎ、(b)だけが起こるような仕掛けを用意すればいい。たとえば、陰イオンだけが選択的に透過するような膜で両室間を仕切るなどの方法が考えられる。
(注意)ネルンストの式を用いる計算で間違いが目立った点。
プリントp. 191下から5行目について。
298Kでは、RT/F = 0.0257 Vなので
(RT/nF) ln x = (0.0257 V/n) ln x = (0.0257 V/n) ×2.303 log x = (0.0592 V/n) ×log x
したがって、p. 192の解説のように、0.0592 V/nを使うときは常用対数を使うことに注意すること。濃度比
x が簡単な整数比の場合には確かに常用対数を使うと便利である。
log 2 = 0.301, log 3 = 0.477 が与えられれば、
log 4 = 2 log 2, log 5 = 1 - log 2, log 6 = log 2 + log 3, log
8 = 3 log 2, log 9 = 2 log 3
のように、log 7 以外の計算が可能である。
逆に電卓を用いて計算するときには自然対数と常用対数を間違えないように注意が必要である。温度が298 Kでない場合など、関数電卓を使うような複雑な計算の場合には、ln x = 2.303 log x の変換をしないほうが間違いが少ない。
(1)
3.注意:日本語での配位子名の順序は、1990年より英語の順序をそのまま字訳するように改訂されています。
1) テトラアンミンアクアヒドロキソコバルト(III)硫酸塩
tetraammineaquahydroxocobalt(III) sulphate
2) ペンタアンミンイソチオシアナトコバルト(III)塩化物
pentaammineisothiocyanatocobalt(III) chloride
注意:IUPACによる1990年の勧告により、:NCS-は「イソチオシアナト」は「チオシアナト-N」と呼ばれるようになっている。同様に、:NO2-も「ニトリト-N」と呼ばれるが、こちらは「ニトロ」も使ってよい。したがって、この問の答えは現在では
ペンタアンミンチオシアナト-N-コバルト(III)塩化物
pentaamminethiocyanato-N-cobalt(III) chloride
が正しい。
3) ヘキサシアノ鉄(III)酸カリウム
potassium hexacyanoferrate(III)
4) ヘキサクロロ白金(IV)酸カリウム
potassium hexachloroplatinate(IV)
5) ヘキサアクア鉄(II)硫酸塩
hexaaquairon(II) sulphate
6) テトラカルボニルコバルト(I)酸ナトリウム
sodium tetracarbonylcobaltate(I)
7) ビス(エチレンジアミン)コバルト(II)塩化物
bis(ethylenediamine)cobalt(II) chloride
8) トリス(ビピリジジン)クロム(III)塩化物
tris(bipyridine)chromium(III) chloride
9) ビス(アセチルアセトナト)銅(II)
bis(acetylacetonato)copper(II)
10) μ-ヒドロキソビス(ペンタアンミンクロム(III))塩化物
μ-hydroxobis(pentaamminechromium(III)) chloride
(2)[CoIIICl2(NH3)4]+ (1) +1 (2) 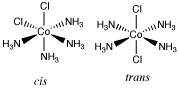
(2)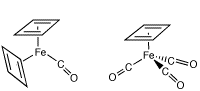
(1)(1) B2H6, SiH4, PH3, AsH3など。(2)(教科書等を参照)
(3)NaO2, SO3