6,7立体化学
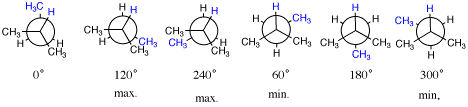
1[2]青色がねじれ角を決めるときに注目する置換基。手前(2-位)ではHであることに注意。
左の三つが重なり形(エネルギーが極大)、右の3つがねじれ形(エネルギーが極小)。

配座解析:maxの角度で最大値、minの角度で最小値となるように角度−エネルギー図を描く。0°が最大ではなく、180°が最小ではない点に注意。
2(ポイント)環はいす形で,メチル基はエカトリアル方向。
アキシャル水素は6個、エカトリアル水素は5個。
3立体異性体を区別しなければ4通り。鏡像異性体を区別しなければ(ジアステレオ異性体は区別する)7通り。鏡像異性体を区別すれば9通り。環反転による配座異性体も区別すれば14通り。
(ポイント)環はいす形。
位置異性体は1,1-、1,2-、1,3-、1,4- 置換体の4通り。
1,2-、1,3-、1,4- 置換体には、それぞれcis形とtrans形の立体異性体(ジアステレオ異性体)がある。
1,2-、1,3- 置換体のtrans形には、それぞれ鏡像異性体がある(cis形はメソ体なので鏡像異性体はない)。
trans-1,2-(2種類)、cis-1,3-(1種類)、trans-1,4-(1種類)置換体には、それぞれ環反転を起こすと形の異なる配座異性体になる。cis-1,2-置換体が環反転を起こすと、もとの形と鏡像の関係にある配座異性体になる(だから鏡像異性体は存在しない)。(1,1-、trans-1,3-、cis-1,4-
置換体は、置換基の一方がアキシャル方向、もう一方がエカトリアル方向であり、環反転しても、もとと同じ形になる)。
一つ一つ分子模型を組んで確かめてみよう。
4[5]例
(1) は1S,3S-体を例示した。1R,3R-体((3)の解答)を用いて回答してもよい。
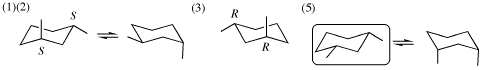
(4) 鏡像異性体
5(任意課題)0.0098%-0.022% 程度であればよい。
(解答例) x = exp(-21×103 J mol-1/8.31
J K mol-1×300 K)
= 2.2×10-4
DE = 23 kJ mol-1を用いると、もう少し小さくなる。
(注意)この割合は、厳密には「一つのねじれ形」の「一つのイス形」に対する割合であり、「ねじれ形」と「イス形」の存在比を表しているわけではない。詳しくは「物理化学I」「化学熱力学」で学びます。
復習課題
追1、追2 リンク先「6.立体化学(1)」の回答4、5
追3
[6]青色がねじれ角を決めるときに注目する置換基。
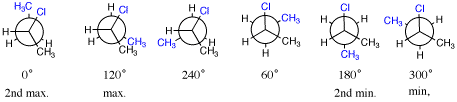
メチル基同士の重なり形がエネルギー最大。これも、0°が最大ではなく、180°が最小ではない。

7.(1) c = 0.1 g/mL, l = 10 cm = 1 dm, θ= -3.1°(deg).
α = θ/(cl) = -31 deg/(mL dm)
上より、R異性体が多い。その比旋光度は-62°
-31 deg/ -62 deg = ((100-x) - x)/100 より
x = 25%
(2) (75-15)/(75+15)×100 = 67%
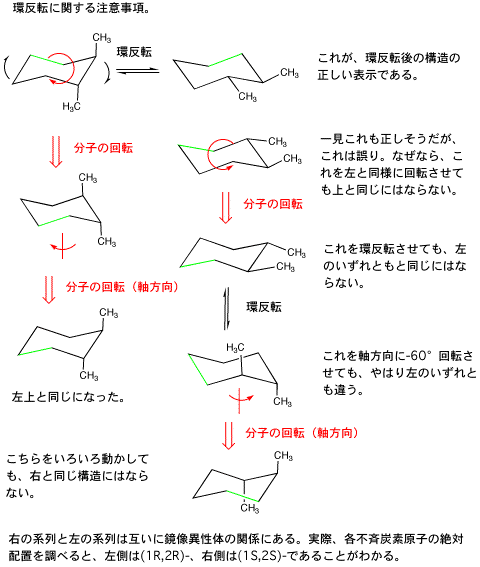
1-ethyl-2-methylcyclohexane などでも事情は同じ。
しかし、cis-1,2-dimethylcyclohexane では事情が異なる。
1.3.
2.解答はこちら
理由
1.(ヒント)共役塩基に対するニトロ基の-I効果(電子求引性誘起効果)の影響、距離との関係に言及すること。
2.(ヒント)塩基に対するニトロ基の-R効果(電子求引性共鳴効果)の影響、置換位置との関係および加成性に言及すること。

3.(2) 理由(ヒント)共役塩基の負電荷の非局在化の様子を、共鳴式などを用いて説明する。
(3) トリフルオロメタンスルホン酸(CF3SO3H)のほうが酸性が強い。
理由(ヒント)F原子の-I効果の影響に言及すること。
重要:酸性(塩基性)の強さを比較するときは、共役塩基(塩基)の非共有電子対の非局在化の程度を比較する。言葉だけで違いを説明することは難しいので、化学式を示しながら説明するのがよい。
復習
矢印は電子の流れる方向を示している。授業に出ていなくて何をすべきかわからなかった人は、テキスト(プリント)10-6ページを参照して下さい。これがわからないと先に進めません。
(5)(6)で、カルボニル基の隣(α位)のCHに塩基が接近する件は、15章、16章で学びます。今はわからなくても構いません。
1.(1) 求核種 (2) 求核種 (3) 求電子種 (4) 求核種
2.(1) C (2) 発熱反応 (3) Aと最初の遷移状態とのエネルギー差 (4) 反応中間体
3.(略)
4.およそe (= 2.72) 倍。
活性化エネルギーが200 kJ/mol 程度になると、50〜100 ℃付近
1.(1) CH3CH2OCH3 (2) CH3CH2CH2CH2Br (3) (CH3)3COH
methoxyethane 1-bromobutane 2-methyl-2-propanol
注意(重要):CH3CH2OHのC-O結合は、NaOHの場合と異なり、共有結合です(しかもC-Cより強い)。OH基は弱い脱離基なので、CH3CH2OHなどからひとりでにOH-が脱離することはありません(だからエタノール水溶液は中性ですし、有害なOH-の生成を心配することなく、大人はこれを飲んでその生理作用を楽しむことができるのです)。C-O結合が切れるのは、(2)のように、酸性条件下でプロトン化してOH2+(=よい脱離基)となり、OH2(水)として脱離する場合がほとんどです。OR基も同じです。
2.(省略)
3.(ここを参照)
4.
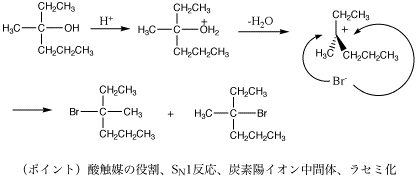
5.(省略)
6.演習問題2(1)(2)ヒント:どちらもSN1反応である。
(3) ヒント:アルキル基1個なのでSN2反応である。FとIのうち脱離しやすいのはどちらか?
演習問題3(a) 脱離しやすさの順は?テキスト参照。
(b) SN1反応に必要な、ハロゲンが取れた陽イオンC6H5+は安定化されているか?
SN2反応で求核試薬が近づくための空間は空いているか?
演習問題5 構造と反応性の関係。テキストおよび問題3(b) 参照。
解答はこちら。(問題3は上のヒントがわかればわかるので省略)
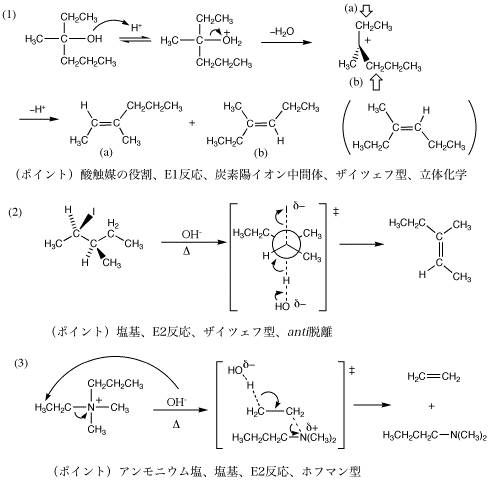
1.
2.
3.演習問題1ヒント:(1) 塩基は存在しないのでE1機構。ザイツェフ則に従う。
(2) 塩基が存在するのでE2機構。アンモニウムイオンなのでホフマン則に従う。
(3) 硫酸酸性で6価のクロム化合物(酸化剤)を作用させている。
演習問題2ヒント:(1)〜(3)は塩基が存在する→E2。(3)は脱離の方向にも注意。
(4) 硫酸がOH基にH+を与えて、よい脱離基が生じる。強酸性下なので塩基は働かない→E1。立体化学にも注意しよう。
解答例はこちら。
1.
2.
問題1.(ヒント)(1)(2)(5) trans付加。(6) ラジカル反応の開始剤が存在する。(8)マルコフニコフ則。(10) オゾン酸化。
問題2.(ヒント)(1)(3)(5)接触水素化の立体化学。(2)(4)高酸化数金属酸化物による酸化反応。
解答例はこちら(課題以外の解答例も記されているので問題番号に注意してください)
1.(ヒント)(a) ニトロニウムイオンの生成経路を説明する(化学反応式も示す) (b) ペンタジエニル陽イオン中間体の生成と反応について説明する(図式を用いるとよい)
((a)(b)の用語の意味を説明する問題ではないので勘違いしないように)
2.(ヒント)活性化基のついたものは? c, e
3.(a) m-dinitrobenzene (1,3-dinitrobenzene)
(b) 1-(2-methoxyphenyl)ethanone (o-methoxyacetophenone),
1-(4-methoxyphenyl)ethanone (p-methoxyacetophenone)
(c) 2-methylbenzenesulfonic acid (o-toluenesulfonic acid),
4-methylbenzenesulfonic acid (p-toluenesulfonic acid)
(d) 2-bromoethylbenzene, 4-bromoethylbenzene
(e) 2,4-dinitromethylbenzene (2,4-dinitrotoluene), 2,6-dinitromethylbenzene
(2,6-dinitrotoluene)
(f) 4-bromo-2,6-dichloromethoxybenzene (4-bromo-2,6-dichloroanisol)
((a)〜(f)の構造式は下を参照)
(g) 塩化p-トルエンジアゾニウム; 4-methylbenzenediazonium chloride
(h) 4-methoxy-4'-methylazobenzene; 4-(4-methoxyphneylazo)toluene
(i) テレフタル酸;benzene-1,4-dicarboxylic acid
((g)〜(i) の構造式は下を参照)
4.(ヒント)問題1 (1)(2)(4)配向性を考える。(5)(6)活性化基が反応位置を決める。
問題7および問題3 置換基による反応性の比較。
問題9 ジアゾニウム塩からのSN1Ar反応。
1.
(4) (CH3)2CHCH=O + C6H5NHNH2 → (CH3)2CHCH=NNHC6H5 + H2O
2.
3.(ヒント)(1)グリニャール反応 (7) 酸素求核試薬:アセタールの生成 (11) 第一級窒素の求核試薬:イミンの生成。 (14) 第二級窒素の求核試薬:エナミンの生成。 (24) 金属水素化物の反応:水素陰イオンが求核試薬。
4.ポイント:プロトン化、水の求核攻撃、プロトン移動、アミンの脱離
5.(1) CH3COCl + C6H5COO- → CH3COOCOC6H5 + Cl-
(2) C6H5COOCH3 + 2C6H5MgBr → (C6H5)3COH (または (C6H5)3COMgBr + CH3OMgBr )
6.(ヒント)すべてカルボン酸誘導体の求核付加−脱離反応。
(2) 酸ハロゲン化物と求核試薬 (5) 酸無水物と求核試薬 (8) エステルと求核試薬 (10) カルボン酸と求核試薬(OH-)の酸触媒下での反応 (18)
酸無水物と求核試薬
質問への回答
Q1. 上記1.(4)で、Nはプロトン化されないのですか?
A1. いい質問です。確かにこちらも一部はプロトン化されます(酸塩基平衡)。しかし、上の反応でプロトン化されていない原料が消費されると、この速い可逆反応はプロトン化とは逆の方向へと進行します。
実際、多くの反応系では、反応の進行とは無関係のいくつもの化学平衡が生じています。カルボニル化合物の反応のような多段階反応の場合はこれが特に顕著であり、反応経路は決して一本道ではありません。自分で反応を考えるときにうまくいかないのは、(a)反応の進行に必要な化学平衡に気がつかない場合(対策:見落としている経路がないか探す)と、(b)反応の進行に無関係な化学平衡にとらわれている場合(対策:袋小路に陥ったら戻って別の経路を進む)とがあります。
迷路を解くのに似ていますが、袋小路にはちゃんと目印があります。それが見分けられるようになれば、反応生成物に到達するのが容易になるでしょう。
1.(4)から(8)までが(1)〜(5)の回答((1)〜(3)は前章の1.(4)および5.(1)(2)の回答)。
2.ポイント:酸性下、エノール体との平衡、ハロゲン分子との反応
(続きは自分で完成させよ)
ハロゲン分子は「求電子試薬」として働く。ハロゲン分子が「酸化剤」として働くのはこの「求電子性」によるものである。
3.(1) マロン酸ジメチル(MMH)の酸解離定数をK1、メタノールの酸解離定数をK2、反応の平衡定数をKとすると
(2) 求める濃度([MMH])をcとすると、
c= (-1+√41)/20≒0.27 mol/L 27%
4.(ヒント)(3)(15) アルドール反応 (19) 交差アルドール反応 (21)(23) NaBH4による還元ではエステルは還元できない。
1.(略)
2.(1) 2CH3CH2COOCH2CH3 → CH3CH2CO-CH(CH3)COOCH2CH3
+ CH3CH2OH
(クライゼン縮合、-が生成したC−C結合)
(2) CH3CH2CH2CHO + Ag2O → CH3CH2CH2COOH + 2Ag
(アルデヒドの酸化、銀鏡反応)
(3) 4CH3COCH2CH2COOCH2CH3
+ NaBH4 + 4H2O → 4CH3CH(OH)CH2CH2COOCH2CH3 + NaOH + B(OH)3
(エステルはNaBH4 では還元されない。NaBH4との反応で生じる塩は
Na+[B(CH3CH(O-)CH2CH2COOCH2CH3)4]
である)