第2回
1.(1) Na+ (2) S2- (3) Mg2+ (4)
Ne
(A)(B)とも同じ。
2.(1) 極性のある(小さい)共有結合 (2) 極性のある(大きい)共有結合
(3) イオン結合 (4) 極性のある(小さい)共有結合
注意:(1)と(4)では、「極性がない」と答えた例が目立ったが、大小の違いはあっても、同一原子間でない限りどんな共有結合にも極性はある。それは、電気陰性度の差として数値化されている。高等学校では簡単のためにC-H結合の極性は「ないと見なしてきた」だけである。
また、「分子の極性」は、各結合の極性ベクトルの総和で決まるので、結合に極性があっても、分子には極性がほとんどないか、全くない場合がある。これについては第5章で学ぶが、両者を区別し、見極めることが重要である。
3. 考え方:(1) C3H8の分子量:C3: 12.01×3=36.03 H8: 1.01×8=8.08
36.03+8.08=44.11
C: (36.03/44,11)×100=81.7
H: (8.08/44,11)×100=18.3
(1) C: 81.7%, H: 18.3% (2) C: 82.7%, H: 17.3%
(3) C: 85.6%, H: 14.4% (4) C: 85.6%, H: 14.4%
(プラスマイナス0.5%は許容)
後半の問題は、大学・企業での研究・開発・その他の仕事や社会生活でしばしば遭遇する「正解がいくつかある問題」の典型である。問題文は複数の視点から捉えることができる。自分の視点を明確にして問題文と計算結果を検討し、論理的に考察すれば、何らかの答えに到達するはずである。以上の過程が重要であり、視点を示さずに単に回答したのでは、正解とは言えない。また、複数の可能性があって明確な結論が得られないときは、可能性を列挙した上で「何とも言えない」と回答すればよい。これは「わからない(思考の放棄)」とはまったく異なる。
少なくとも高校〜大学入試までは、このような問題にぶつかった経験はあまりないのが普通である。しかし、上のような実情を考えると、このような問題に対応する経験を、大学生の間に何度か経て慣れておくことはとても重要なことである。今はあえて解答例を記さないので、無回答または視点を意識せず機械的に回答した諸君は、次回改めて「自分の」回答を提出することを望む。
(質問)結合の極性の有無はどのように判断すればいいのか。
Q&Aの「化学基礎論」(7)を参照して下さい。
第3回
4.(1) (例)くさび形:紙面(画面)から手前向きに伸びる。
点線:紙面(画面)から向こう(奥)向きに伸びる。
モルタロウ使用者
(2) ∠HCH = 約120°、∠HCO = 約120°
丸善HGS模型使用者
(2) (a) ∠HCH = 約110°、∠HCO = 約125°
(b) ∠HCH = 約120°、∠HCO = 約120°
(b)のほうが実際の角度に近い。
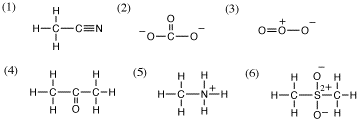
5.(1) H: 0、C(CH3): 4-(1×4) = 0、C(CN): 4-(1+3) = 0、N: 5-(3+2) = 0
(2) C: 4-(1×2+2) = 0、O(左右): 6-(1+2×3) = -1、O(上): 6-(2+2×2) = 0
(3) O(左): 6-(2+2×2) = 0、O(中): 6-(2+1+2) = +1、O(右): 6-(1+2×3) = -1
(4) H: 0、C: 4-(1×4) = 0、O: 6-(2+2×2) = 0
(5) H: 0、C: 4-(1×4) = 0、N: 5-(1×4) = +1
(6) H: 0、C: 4-(1×4) = 0、S: 6-(1×4) = +2、O: 6-(1+2×3) = -1
5-2.それぞれ、次のような構造式と対応する。
形式電荷を求めることにより何がわかるか?:化学式が与えられた分子やイオンの構造がどうであるか、見当をつけることができる。また、自分で求めた化学式や電荷の数に問題がないかどうかを見極めることができる。
(1) エタンニトリル(アセトニトリル)、(2) 炭酸イオン、(3) オゾン、(4)プロパノン(アセトン)、(5)メチルアンモニウムイオン、(6) ジメチルスルホン
6.(a) N: +1,電荷:+1、 (b) N: +1,O(上):−1,O(下):0,電荷:0、
(c) S: +2,O: −1,電荷:−1 、 (d) C: -1,電荷:−1、
(e) P: +1,O:−1, 電荷:0、 (f) B: −1,F:0, 電荷:−1
(質問)オクテット則とは?(無機化学関連FAQ(5))
(質問)Na、K、CaなどとCとの化学結合が不安定なのはどうしてか?(結合と構造FAQ(22))
いくつかの質問への回答
(1) 異性化反応とは?[有機化学反応概論Q8]
ある化合物がその異性体に変化する反応。
(2) CCl4は有機物か無機物か?[序論、全般(19)]
(3) 異なる原子間の化学結合が共有結合かイオン結合かはどうやって区別するか?[化学基礎論(7.2)]
(4) 有機化合物の炭素原子に結合した水素原子を他の原子に変えたら、形や結合角は変わるのか?[立体化学(20)]
(5) ひずみエネルギーとは?どのようにして生じるのか?[立体化学(21)](化学結合論)
(6) 有機化合物の構造決定の歴史は?[序論、全般(1a)]
3.飽和炭化水素
1.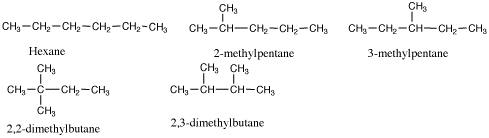
2.(a)(c)(f)(i) pentane, (b)(d)(e)(g) 2-methylbutane, (h) 2-methylpropane
3.
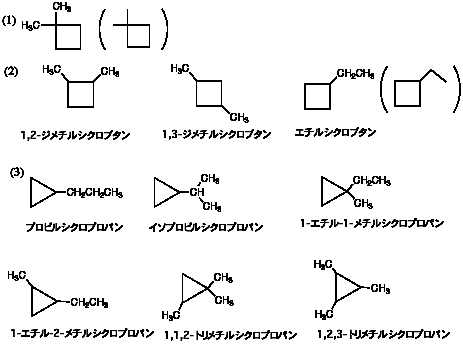
この他にも環状の異性体がある。
2つめの「イソプロピル」は組織名では「1-メチルエチル」なので、「(1-メチルエチル)シクロプロパン」でも正しい(使う人はほとんどいない)。なお、IUPACの1993年の勧告では、propyl
は propan-1-yl(プロパン-1-イル)、isopropyl は propan-2-yl と書いてもいい。しかし「2-プロピル」は誤りである。
4.(1) C10H18, IHD
= 2 (2) C13H22, IHD
= 3 (3) C10H18, IHD
= 2 (4) C10H18, IHD
= 2
(1) (2) は縮合多環炭化水素、(3) は橋架け環炭化水素、(4) はスピロ炭化水素の仲間である。
(5) 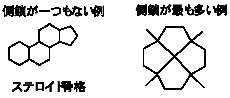 他に多数考えられる。
他に多数考えられる。
ステロイド骨格は、性ホルモンをはじめとして多数の天然物がもっている。
(1)〜(4)で与えられている構造はそれぞれ環どうしのつながり方が違っているので、(5)を考える上でヒントになるはずである。
注意:このような問題では、設定されている条件をみたしている回答かどうかの判断力が求められています。条件をみたしていない誤答が目立ちました。問題文をよく読み、条件をみたしているかどうかを判断してから回答して下さい。
考えられる限りの条件を自分で設定して(場合分けして)、各条件(場合)を満たしている構造をもれなく描き出すことは、異性体の問題に正しく回答するための重要な手順です。
1.
IUPACの1993年および2013年勧告では、1-butene は but-1-ene(ブタ-1-エン)、2-pentene は pent-2-ene(ペンタ-2-エン)のように書いてもいい(海外では1993年以前にも慣用的に使われる場合があった)。しかし、英語綴りと日本語訳とが一致していないためか、国内では普及していない。
注意:E、Z異性体を H | CH3C=CCH2CH3 と CH3C=CCH2CH3 | | | H H H のように描いて区別しようとしている回答がいくつかあるが、これらはどちらも CH3CH=CHCH2CH3 と同じであり、区別したことにならない。必ず上の解答例のように斜めの結合(棒)を 用いて描くこと。
2.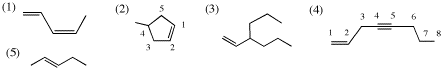
(1) IHD = 2 (2) IHD = 2 (3) IHD = 1 (4) IHD = 3 (5) IHD = 1
3.(1) 略。
(2) (実際に測って3桁目まで報告してほしい。模型でのプラスマイナス1 mm(実際での0.005 nm)程度の誤差は許容する。)
(a) 0.15 nmくらいか。(b) 0.24 nmくらいか。
(c) 最近接の水素原子どうしがもっとも離れたとき以外は、メチル基どうしは互いに反発する可能性が高い。
(3) (例)(Z)-2-ブテンでの(2) (c) に記したようなメチル基どうしの反発は(E)-2-ブテンでは起らないと考えると、(E)-2-ブテンがより安定だと考えられる。
4.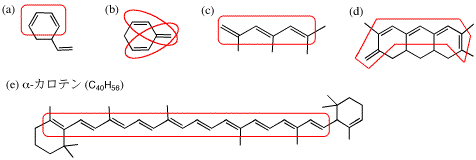
共役二重結合(共役系)は、長く伸びていても一組である点に注意すること。
5.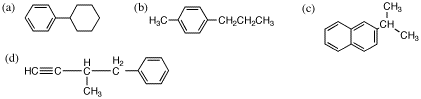
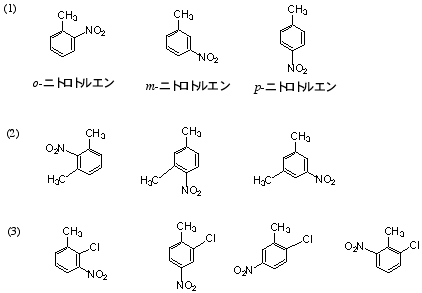
(b) の名前は、4-プロピルトルエン(または1-メチル-4-プロピルベンゼン)が正しい。
6.C9H12のIHD = 4 よりベンゼン環以外に不飽和結合や環はない。

2置換の場合は、o-エチルトルエンなど(m-、p-)の代わりに2-エチルトルエンなど(3-、4-)でも誤りではない(エチルメチルベンゼンを用いる場合には、アルファベット順で先に来るエチル基の位置番号が小さくなるので、命名法によって同じ置換基の位置番号が違ってくる)。
1,3,5-trimethylbenzene は mesitylene(メシチレン)ともいう。
7.2,4-ペンタジエニルカチオン(陽イオン):CH2=CH-CH=CH-CH2+
2,4-ペンタジエニルアニオン(陰イオン):CH2=CH-CH=CH-CH2-
π電子の非局在化の様子を表す方法の一例。特に指示がなければ左右どちらの方法に基づいていても良い。電荷は、今のところは共役系全体に非局在化すると考えて良い(電荷がどう分布するかは有機化学IIで学ぶ)。
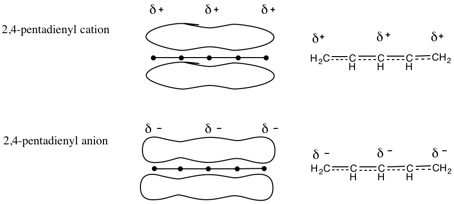
(説明の例)
カチオン(陽イオン)では、4個のπ電子が5つの炭素原子の間に非局在化し、+(正)の電荷はπ電子系全体に非局在化している。
アニオン(陰イオン)では、6個のπ電子が5つの炭素原子の間に非局在化し、−(負)の電荷はπ電子系全体に非局在化している。
(補足)基名の位置番号は、基の付け根(−)の位置が小さくなるようにつける(不飽和結合より優先)。
CH2=CH-CH=CH-CH2-では、右端の-CH2-が1-位になるので、2,4-ペンタジエニル基となる。
上の例のように基名の後に「〜カチオン(陽イオン)」や「〜アニオン(陰イオン)」をつけてイオンを表すのは慣用名だが、IUPAC命名法(2013年)では許容されている。
陽イオンのIUPAC命名法:中性の基(ラジカル)が電子を1個失って(炭化水素がH-を失って)できる陽イオンの名前は、基名の後に「〜イウム(-ium)」をつける。上の例では、2,4-ペンタジエニリウムまたはpenta-2,4-dien-1-ylium (2013年)。
陰イオンのIUPAC命名法:中性の基(ラジカル)が電子を1個得て(炭化水素がH+を失って)できる陰イオンの名前は、炭化水素名の語尾に「〜イド(-ide)」をつける。上の例では、2,4-ペンタジエニドまたはpenta-2,4-dien-1-ide (2013年)。
Q.いくつかの質問への回答
(Q1) どのようなときにE、Zを使い、どのようなときにcis、trans
を使うのか。
(A1) E、Zはどのような場合にも使えます。IUPACの勧告にも沿っていますので、こちらを使うのがいいと思います。cis、trans
を使うときは、注目する置換基(2つ)を指定するのが原則です。ただし、エテンの各炭素の水素原子を一つずつ他の置換基で置換した場合(1,2-二置換アルケン)には、注目する置換基は自明ですので、指定しないで使われます。
(Q2) 次の2つの構造は名前が違うのか?
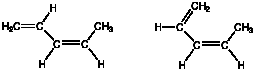
(A2) どちらも同じ構造式を表し、名前は(Z)-1,3-pentadiene で同じです。
ただし、どちらも安定な配座異性体(第6章で学ぶ)であり、形は異なります。(以下はやや発展的内容)配座異性体を区別するときには、左はap
(anti periplanar) 形、右はsp (syn
periplanar) と呼んで区別します(詳しくは、参考文献の欄にある「立体化学」の参考書をご覧下さい)。
(Q3) 有機化合物の炭素原子に結合した水素原子を他の原子に変えたら、形や結合角は変わるのか?
(A3) 単結合は速やかに回転できますが、第6章で学ぶ安定な配座が変わるために、形が変わる場合があります。また、結合の長さや結合角は、最適の長さや角度を基準として、常に振動していますので、分子内の原子の相対的な位置はいつも一定なわけではありません。いいかえれば、(単原子分子以外の)分子は結合の振動や回転のために、常に形を変えているのです。炭素原子に結合している原子が変わると、結合の長さが変わるために、分子内の他の原子とのぶつかり合いが生じ、そのために最適な長さや角度が変わることはよく起こります。
(Q4) IUPAC名はアルファベットで書く方がカタカナよりもいいのか。
(A4) アルファベットで書くのは国際共通の方法である。しかし、IUPACは、各国語の文字や語法を用いて表記することを認めている。したがって、日本語の文章の中ではカタカナや漢字を用いてよい。逆に、国内では、単に英語の綴りをカタカナにしただけの用語は誤りの場合もある。例:○酢酸エチル、×エチルアセテート。○塩化アセチル、×アセチルクロリド。
(Q5) 形式電荷を求めることにより何がわかるか?
(A5) 化学式が与えられた分子やイオンの構造がどうであるか、見当をつけることができる。また、自分で求めた化学式や電荷の数に問題がないかどうかを見極めることができる。
1.(1) 無極性分子 (2) 極性分子 (4) 無極性分子
(注意)(3) はイオン性物質なので、この分類にはあてはまらない(第2回2.参照)
2.(1) 略
(ポイント)
(2) (a) C-OとC-N、H-OとH-Nの極性の大きさの違いに注目。
(3) (c) 2本のCl-C結合の極性の方向は、C=Oと逆向きである点に注目。
(4) (c) C-OとC=Oの極性の大きさに注目。
3.(1) (a) 第一級アミン (b) 第二級アルコール (c) 第二級アミン (d) 第一級アルコール
(e) 第四級アンモニウム塩 (f) 第三級アミン (g) 第三級アルコール
(2) (f) ((e) は分子性物質ではないので考慮しない)
4.(a) 2-プロパンアミン(イソプロピルアミン) (b) 2-プロパノール
(c) N-メチルイソペンチルアミン(N-メチル-3-メチルブチルアミン、N-メチル-3-メチルブタンアミン) (d)
2-メチル-1-プロパノール
(e) 塩化テトラエチルアンモニウム(tetraethylammonium chloride)
(f) N,N-ジメチルアニリン (g) 2-フェニル-2-プロパノール
(a) で「2-プロピルアミン」は誤り。(CH3)2CH-は「1-メチルエチル基」(慣用名は「イソプロピル基」)であり、「2-プロピル基」ではないから。
(b) で「2-プロピルアルコール」「イソプロパノール」は誤り。前者は(a)と同じ理由から。後者は、「イソプロパン」という炭化水素がないから(命名法の誤用)。「イソプロピルアルコール」は慣用名としては正しいが、IUPACは使用を推奨していない。
(第8回)
5.(1)(2)
6.(ポイント)水素結合による会合に言及すること。
7.(1) -1 × (2) 1 (3) 1.5 (4) 5 (5) -0.5 × (6) -1 ×
ただし、アンモニウム塩などのような配位化合物の場合には、IHD が負になる
ことがある。上の場合には次のような例がある。
(1) CH3O+H−CH2CH2CH2O+H−CH3 (5) C6H13-NH3+
これを答えても正解になる。
「構造異性体のまとめ」で説明したように、各化学式と合う構造は多数存在す
る。ここではそのうち一つを答えればいい。解答例はこのファイルの2.を参照。
8.(1) O: 100-(42.87+2.40+16.66) = 38.07
相対質量から原子数の比(原子のモル比)を求める。
C: 42.87/12.01 = 3.57
H: 2.40/1.008 = 2.38
N: 16.66/14.01 = 1.19
O: 38.07/16.00 = 2.38
簡単な整数比を得るために、まず最も小さなものを1と仮定する。
C: 3.57/1.19 = 3
H: 2.38/1.19 = 2
N: 1
O: 2.38/1.19 = 2
C3H2NO2
もし整数からかけ離れた数字が現れた場合には、それが整数に近づくようにすべてを整数倍する。
(2) 分子式は(C3H2NO2)n となるはず
組成式の式量は12.01×3+1.008×2+14.01+16.00×2 = 84.06
84.06×2=168.12 が条件に合う。分子式は(C3H2NO2)2 = C6H4N2O4
(3) 分子式よりIHD = 6。ベンゼン環はIHD = 4、ニトロ基(-NO2)はIHD = 1に対応する。考えられる構造はジニトロベンゼンの位置異性体(o-、m-、p-)。構造式は このファイルの4.を参照。
9.(1) (c) < (a) < (b) (2) (c) < (b) < (a)
10.(1) (a) < (b) < (c) (2) (c) < (b) < (a)
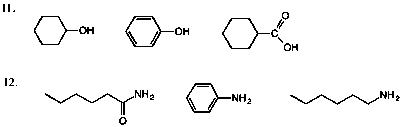
11.下図の11 を参照。
12.下図の12 を参照。
重要:酸性(塩基性)の強さを比較するときは、共役塩基(塩基)の非共有電子対の非局在化の程度を比較する。非局在化しているほど塩基性は弱い(共役酸の酸性は強い)。言葉だけで違いを説明することは難しいので、化学式を示しながら説明するのがよい。
13.(1) (a)を参照 (2) (b) を参照
( )で囲んだ構造は不安定であり、下に示した反応で速やかに他の物質に変化する。
(b) にはさらに CH3-CH=CH-OOH、CH2=C(OOH)-CH3 が考えられる。
14.(a) C: 57.66% H: 11.61% O: 30.72% IHD = 0
(b) C: 55.78% H: 11.70% N: 32.52% IHD = 1
(c) C: 45.56% H: 3.82% O: 30.34% S: 20.27% IHD = 4
(d) C: 52.35% H: 11.72% N: 10.18% Cl: 25.75% IHD = -1
構造式の解答はこのファイルの3.を参照。
Q.質問への回答
(Q) 8.(1) に関連して、C4H6の異性体の一つ、![]() のIUPAC名を教えて下さい。
のIUPAC名を教えて下さい。
(A) bicyclo[1.1.0]butane(ビシクロ[1.1.0]ブタン)です。
このように、二つの環が一本以上の結合を共有している(縮環)化合物を、ビシクロ化合物といいます。環を構成する「鎖」をbridge(架橋部)といい、3つのbridgeが集まっている原子をbridgehead(橋頭位)といいます。以下に母核の名前のつけ方を簡単に説明します。まず、冒頭に「ビシクロ」とつけます(脂環式化合物の「シクロ」と同じ要領)。次に、各bridgeを構成する原子数を大きい方から順に"."(ピリオド)でつないで、[
](かぎ括弧)の中に入れます。最後に環を構成する原子数に対応する炭化水素名をつけます。不飽和結合や他の置換基・官能基がある場合の取扱いも通常の命名法と同じですが、位置番号の付け方には縮環化合物に特有の規則がありますので、詳しくは命名法の参考書を参照して下さい。
1.(2E,4E)-、(2E,4Z)-、(2Z,4E)-、(2Z,4Z)- の4種類。
![]()
2.60°、180°、300°(-60°)の3種類。
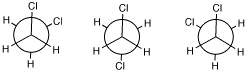
3.(1) ねじれ形:6つ、重なり形:なし (2) ねじれ形:4つ、重なり形:2つ(舟の中ほど、左舷と右舷に対応する結合の周りが重なり形配座)。
4.[2]青色がねじれ角を決めるときに注目する置換基。手前(2-位)ではHであることに注意。
左の三つが重なり形(エネルギーが極大)、右の3つがねじれ形(エネルギーが極小)。
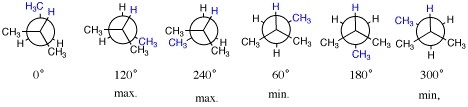
配座解析:maxの角度で最大値、minの角度で最小値となるように角度−エネルギー図を描く。0°が最大ではなく、180°が最小ではない点に注意。
5(ポイント)環はいす形で,メチル基はエカトリアル方向。
アキシャル水素は6個、エカトリアル水素は5個。
6(任意課題)0.0098%-0.022% 程度であればよい。
(解答例) x = exp(-21×103 J mol-1/8.31
J K mol-1×300 K)
= 2.2×10-4
DE = 23 kJ mol-1を用いると、もう少し小さくなる。
(注意)この割合は、厳密には「一つのねじれ形」の「一つのイス形」に対する割合であり、「ねじれ形」と「イス形」の存在比を表しているわけではない。詳しくは「物理化学I」「化学熱力学」で学びます。
7.下の(1)〜(3) 。(1) (3) はいずれか一方であればよい。
8.(2) (a) 下の(4) (b) 下の(5)
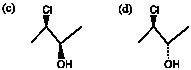
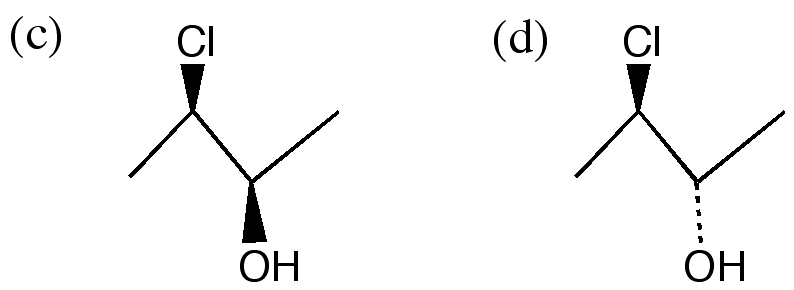
(3) 鏡像の関係ではない(ジアステレオ異性体)。
9.下のいずれか。
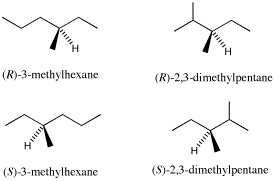
10. [5]例
(1) は1S,3S-体を例示した。1R,3R-体((3)の解答)を用いて回答してもよい。
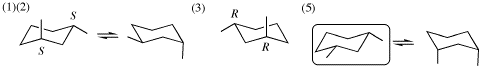
(4) 鏡像異性体
11. 「異性体」を区別する問題では、通常は「立体配座の違い(配座異性体)」は考えない。
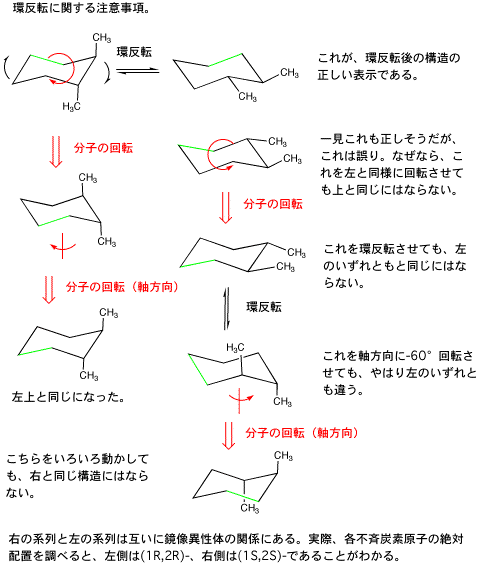
構造異性体(位置異性体)のみを考え、立体異性体を区別しなければ4通り。鏡像異性体を区別しなければ(ジアステレオ異性体は区別する)7通り。鏡像異性体を区別すれば9通り。
うっかりすると、環反転による立体配座を区別して描いてしまうことがある(この場合14通りになる)ので注意*すること。
(ポイント)環はいす形。
位置異性体は1,1-、1,2-、1,3-、1,4- 置換体の4通り。
1,2-、1,3-、1,4- 置換体には、それぞれcis形とtrans形の立体異性体(ジアステレオ異性体)がある。
1,2-、1,3- 置換体のtrans形には、それぞれ鏡像異性体がある(cis形はメソ体なので鏡像異性体はない)。
以上が区別されていればいい。
*(注意)trans-1,2-(2種類)、cis-1,3-(1種類)、trans-1,4-(1種類)置換体は、それぞれ環反転を起こすと形の異なる立体配座になる。cis-1,2-置換体が環反転を起こすと、もとの形と鏡像の関係にある立体配座になる。(1,1-、trans-1,3-、cis-1,4- 置換体は、置換基の一方がアキシャル方向、もう一方がエカトリアル方向であり、環反転を起こしても、もとと同じ形になる)。
一つ一つ分子模型を組んで確かめてみよう。 .
12.(1) +25.2° (2) -5.04°
1-ethyl-2-methylcyclohexane などでも事情は同じ。
しかし、cis-1,2-dimethylcyclohexane では事情が異なる。
1.
(1) 置換(縮合) (2) 付加 (3) 脱離 (4) 異性化 (5) 置換
(2.は次回まとめて公開)
3.(1) (略) (2) 0.50 mol,44 g (3) 61% (4) 50%
1.(1) CH3CH2OCH3 (2) CH3CH2CH2CH2Br (3) (CH3)3COH
methoxyethane 1-bromobutane 2-methyl-2-propanol
求核試薬:CH3CH2O- Br- OH-
脱離基: I H2O+ (OH) I
注意(重要):CH3CH2OHのC-O結合は、NaOHのNa+-O結合の場合と異なり、共有結合です(しかもC-Cより強い)。OH基は弱い脱離基なので、CH3CH2OHなどからひとりでにOH-が脱離することはありません(だからエタノール水溶液は中性ですし、有害なOH-の生成を心配することなく、大人はこれを飲んでその生理作用を楽しむことができるのです)。C-O結合が切れるのは、(2)のように、酸性条件下でプロトン化してOH2+(=よい脱離基)となり、OH2(水)として脱離する場合がほとんどです。OR基も同じです。
2.(1) CH3COCl + C6H5COO- → CH3COOCOC6H5 + Cl-
(2) C6H5CONHCH2CH3 + H2O → C6H5COOH + CH3CH2NH2
3.(略)
4.
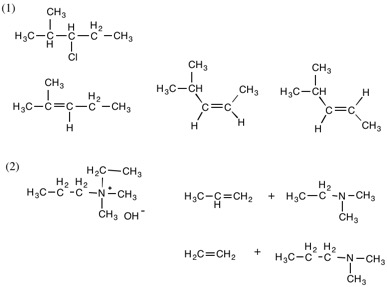
1.(構造式は略)
(1) bromocyclopentane (2) cis-1,2-dimethylcyclopentane
2.(2)(ポイント)trans付加。生成物はmeso-体なので一つだけであることを、分子模型で確認すること。
(3) (2R,3S)-2,3-dichlorobutane
3.
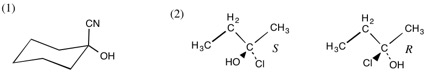
1 (略)
2