目次
意義、目的、勉強法に関する質問/有機化学関係の質問
/序論、全般/命名法/結合と構造/電子状態/炭化水素/共役系と非局在化/構造と性質の関係、水素結合/立体化学/
「有機化学」の授業であるが、内容的には「化学(A・B)」にあてはまる質問が、特に「有機化学I」では多く見られた。これらの質問や有機化学以外の関連分野の質問と簡単な回答を最初に記した。これらの回答に満足できない場合には、該当科目の担当教員やTAにさらに問い合わせるか、該当分野の教科書、参考書を参照されたい。
化学(A・B)
関連する他分野/化学史/構造化学、量子化学、物理化学/無機化学関連/その他/
「有機化学I」のページに戻る 「有機化学II」のページに戻る
(1) 正四面体構造はなぜ安定か(化学)。
(1a) 1個の原子から共有結合やローンペアの電子が4方向に伸びるとき、電子間の反発がもっとも小さいから。
(2) 回転すると2px、2py、2pzは互いに重なるが、そのとき電子の移動は起こるのか(化学)。
(2a) 3つのp軌道は常に互いに直交しているので、原子を回転させても互いに重なることはない。(「電子の移動」とはどのような現象を考えてるのかわからないので、回答は保留します。質問しにきて下さい。)
(3) H2Oは折れ曲がっているのに、CO2は直線構造なのはなぜか(化学)。
(3a) 中心の炭素原子が非共有電子対をもたず、炭素原子の価電子は2個の酸素原子との共有結合だけに使われている。言い換えれば、sp混成となっているため。また、無機化学で「原子価殻電子対反発側(VSEPR則)を学んでください。
(4) 水素原子の電子のエネルギーが負の値となっている(En = -(中略)(1/n2)のはなぜか(化学、量子化学)。
(4a) これは位置エネルギーなので、何を基準とするかで値も符号も変わる。この場合は真空中に孤立した電子(原子核からの距離が無限大)の位置エネルギーを0としており、原子核の正電荷に引きつけられている電子は位置エネルギーがこれより小さい(だからエネルギーを与えないと原子核から離れない)ため負の値になる。
(5) シグマ結合と共有結合の関係は(化学)。
(5a) シグマ結合は共有結合を構成する結合の一種である。
(6) 電気陰性度の数字はどのようにして決められたのか知りたい(化学)。
(6a) Liを1.0、Fを4.0とし、他の原子は結合の極性の程度を基にして経験的に決めた(文献:L. ポーリング「化学結合論」)。
(7) 極性の有無、結合の種類をどう判断すればいいのか(化学)。
(7a) 結合に関わる原子の周期表での位置(つまり電気陰性度の差)をもとにして判断する。次も参照。
(7.2) 異なる原子間の化学結合が共有結合かイオン結合かはどうやって区別するか?(化学)
(7.2a) 異なる種類の原子間の結合は多くの場合、電気陰性度の違いにより電子の分布が一方の原子に偏っているので、極性をもつ。この極性が大きくなるほど、共有結合はイオン結合性を併せ持つことになる。一般に、電気陰性度の差が1.7より大きいと、イオン結合であるとされている。
(8) sp2混成軌道を作ったときの2pz、sp混成軌道を作ったときの2py、2pz、の電子雲はどうして形が変わらないのか。(化学)
(8a) 他の2sおよび2p軌道は互いに混じり合って、同じ形の3つまたは2つの混成軌道に変化した。残ったp軌道は混成軌道には加わっていない(もとのまま変化していない)ので、形が変わる理由がない。
(9) 電子雲が拡がる(電子が非局在化する)とどうして安定になるのか?(化学)
(9a) 「拡がる」結果、「より多くの正電荷(原子核)のまわりに分布する」ので、位置エネルギーが下がる、いいかえれば安定になる。
(10) alleneの中央の炭素は三重結合ではないのにsp混成なのはなぜか。(化学)
(10a) 混成の種類は結合の種類ではなく、炭素原子が結合している相手の数で決まるから。中央の炭素原子は2個の炭素原子としか結合していないので、sp混成になる。
(11) (sp3混成の場合)どうして109.5度になるのか?(化学)
(11a) 原子核を中心として、空間的に見て等価な4つの方向は、原子核を正四面体の中心として、そこから頂点方向に向かう4つの方向です。そこで、正四面体の重心と各頂点とを結ぶ直線同士のなす角について幾何学的に計算すると、この角度になります。
(12) 混成軌道はなぜできるか。(化学)
(12a) 混成軌道は人間の知恵の産物であり、「できる」ものではない(「なぜできるか」を問うのは無意味)。「できる」と考えると、(1)
原子の電子状態を表す解としては、(2s、2pの組み合わせと)等価であり理論的に問題がない。(2) 混成軌道ができると考えると共有結合のできる方向をうまく説明できる。
[化学史]
(1) ベンゼンの構造が正六角形になっているなんてどうして気がついたのか(化学史)。
(1a) 1865年の最初の提案者であるケクレによると、ある夜見た夢の中からヒントを見つけたのだそうである。(参考文献:吉岡、竹内「化学の歴史」(出光書店))
(2) どうやって異性体を発見したのか(化学史)。
(2a) 最初に報告された異性体は無機化合物で、シアン酸銀(AgOCN)と雷酸銀(AgONC)とは分子式が同じなのに性質が異なることをリービッヒとウェーラー(シアン酸アンモニウムから尿素ができる反応を見つけた人)が1824年頃に報告している。
(1) 結合の角度はどのようにして計測するか(分子解析学、分子分光学)。
(1a) 固体:X線結晶解析法、赤外線分光法。 気体、揮発性液体:赤外線分光法、マイクロ波分光法(分子分光学は本学科の正課では教えない)。
(2) 炭素原子がsp3混成をとる科学的根拠は(量子化学)。
(2a) 炭素原子の安定な電子状態を表現するシュレジンガー方程式の解の数学的表現は、実は一通りではなく無限にある(数学的には互いに等価)。2sと3個の2pはその一つ。4個のsp3も、3個のsp2と1個の2pも、2個のspと2個の2pも、それぞれ組み合わせれば互いに等価な解である。
中田宗隆「化学結合論」(裳華房)第5章
中田宗隆「量子化学 基本の考え方16章」(東京化学同人)
中田宗隆「なっとくする量子化学」(講談社)
シュレジンガー方程式についてさらに学びたければ情報システム工学科の小林幸夫先生の扉を叩いて下さい。
(3) s軌道やp軌道で電子同士の衝突は起こるか(量子化学)。
(3a) 古典的な意味での衝突は起こらないが、電子同士の反発はその挙動に影響を与える。
(4) σ結合、π結合の他に結合の名称はあるか。(構造化学)
(4a) 特殊な化合物の場合にはないわけではない。
(5) 油の中に少しの水を入れ、界面活性剤を入れると逆ミセルはできるのか。(物理化学)
(5a) (条件によるが)できる。
(6) 1つの電子軌道に2つしか電子が入らないということにどうして気がついたのか。(量子化学)
(6a) もし3つめの電子が入ると、はじめの2つの電子のどちらかとすべての量子数の値が同じになることになるが、そうなると量子力学の体系が自己矛盾を起こすことをPauliが見出した。
(7) なぜH原子の方がH2分子よりエネルギーが高いのか。(化学結合論、量子化学)
(7a) H原子の電子は1個の原子核の回りだけに存在しているのに対して、H2分子では2個の原子核の回りに存在しており、それだけより非局在化している。「非局在化すればするほどエネルギーが低い(安定になる)」というのが電子のエネルギーの基本的な考え方。
(8) 電子の非局在化とはどういうことか。(化学結合論、量子化学)
(8a) 電子が、より多くの原子核の回りの、より広範囲な空間に広がって存在できるようになること。
(9) 軌道のエネルギー準位の図の↑↓の意味は?(化学結合論、量子化学)
(9a) 電子のスピンの向きを表しています。パウリの原理の本質は「系内の複数の電子は、互いに同一の状態を取ることができない。」というものです。したがって、同じ分子軌道内にある2個の電子は、スピンの向きが互いに逆でなくてはなりません(そうでないと2個の電子が同一の状態を取ることになる)。このことを矢印の向きで模式的にあらわしたもので、化学結合論や量子化学では一般的な表現方法です。
(10) 2sと2pが混成されてsp3を作ったときに、構造的にどんな変化が起こっているのか?(化学結合論、量子化学)
(10a) 講義では時間の都合で説明することができない点をついた良い質問です。
原子の状態では、電子の分布も含めて、何も変化は起こっていません。
(ここからはやや難しい)炭素の2s22p2という電子状態(2p電子は3つの2p軌道に非局在化して分布している)と、(sp3)4という電子状態は、互いにまったく同等なのです。
(以下はかなり難しいのでわからなくても気にしないように)実際には、sp3に対応する波動関数は、上の条件が満たされるような数学的表現の一つなのです。(さらにいうと)上の条件を満たす数学的な表現は無数に考えることができますが、これに加えて「4つの混成軌道が互いにまったく同等になる」という条件をも満たす数学的表現は、唯一つしかありません。これがsp3に対応する4つの波動関数です。
いくつかの入門的なテキストでは、平易さを優先して、上の内容と矛盾する説明(たとえば、「2sの電子を1個だけ2pへと移動(「昇位」または「励起」という。外部からエネルギーを与える必要がある)させてから、4つの軌道を混ぜ合わせる」など)をしている場合がある。これらは(直観的には理解しやすいかも知れないが)厳密には正しくない。
(11) s軌道もp軌道も左右対称なのに、両者を混成してできるsp3混成軌道などはどうして非対称な形をしているのか?(化学結合論、量子化学)
(11a) 99年度から、他の多くの教科書にならって、原子軌道や分子軌道の説明を簡略化したことから生じた良い質問です。回答はやや長いので、ここをクリックしてください。
(12) 炭素と水素は電気陰性度で0.4の違いがあるが、両者間の結合はほんとうに非極性なのか?もし非極性なら、電気陰性度でどのくらい差があれば極性結合と言えるのか?(化学結合論)
(12a) これも良い質問です。
わずかに極性があります。このため、C3以上の多くの炭化水素は、双極子モーメントが(小さいですが)ゼロではありません。しかし、C-H結合の極性は、炭素が水素以外の原子と結合した場合に比べると、無視しても差し支えないくらい小さいですので、有機化学では「無極性」と考えます。
(13) アルコール(R-OH)などで、RについているH(C-H)は水素結合の供与水素(Donor)にはならないのか?(化学結合論)
(13a) なりません。C-H結合の極性は無視できるほど小さいので、このHはδ+とは考えません。水素結合の受容体(Acceptor)となれる部分だけをもつ分子はかなりたくさんあります。これらの分子は、同種分子間では水素結合を生じることはありませんが、供与水素(Donor)となれるHをもつ他の分子とは水素結合することができます。
(14) 単結合の回転は止まることがあるのか?たとえば絶対零度ではどうか?
(14a) 結晶ではほとんどの場合,最も安定な配座異性体で止まっている。しかし,ねじれ角は極小となる角度の付近で振動している。絶対零度の結晶では,振動を含むすべての運動が停止する。
(1) 遷移元素は生命機能とは関係ないのか(生化学、生物無機化学)。
(1a) 関係ある。たとえば、ヘモグロビンという血液中で酸素を運搬しているタンパク質には鉄が含まれている。
(2) どうして二酸化炭素などは無機物として扱われるのか。(無機化学)
(2a) 他の有機化合物とはほとんど反応しない一方で、さまざまの無機化合物と反応して他の化合物に変化するから、無機化合物に分類して、「無機化学」で取り扱うほうが都合がいいから。
(3) NOxの中で、価電子の釣り合いで説明できるのはN2O3だけだが、NOやNO2はどのような状態で存在しているのか?
(3a) 分子を作るときに、価電子殻には電子が必ずしも8個入らなくてもいいのです。COもその一例です。NOやNO2では、N原子のまわりの価電子は8個よりも少ないです。ただし、L殻(つまり第2周期の原子の場合)では8個を超えることはできません。
(4) 形式電荷を求めることにより何がわかるか。
(4a) 化学式が与えられた分子やイオンの構造がどうであるか、見当をつけることができる。また、自分で求めた化学式や電荷の数に問題がないかどうかを見極めることができる。
(5)オクテット則とは?(無機化学関連)
(5a)「八偶子則」ともいう。典型元素の原子が形成する化学結合を理解するために考えられた経験則。イオンや共有結合を作るときに、個々の原子の周りの価電子数が8個になる傾向があるという考え方。第2周期の元素については、価電子数が8個を超えることはないので、概ね成り立つが、それでもCOやNOのように価電子数が8個に満たない原子をもつ化合物もある。第3周期になると、PCl5やSF6のように単純に数えると価電子数が8を超えてしまい、オクテット則に反する化合物もある。遷移元素の化合物ではオクテット則に合わない化合物が増え、特に錯体の結合はまったく説明できない。高校化学で、「価電子殻に電子が8個入ると『閉殻』になって安定する」(「安定する」は不正確、「安定になる」が正しい)と教える場合があるのは、この経験則の名残と考えられる。
(6)「無水ケイ酸」は物質名か?(無機化学命名法)
(6a)SiO2を表す名前として慣用的に使われることがあります。ただし、「無水〜」という表現はいくつかの異なる意味で使われますので、自然科学の文章で用いられる「体系名(IUPAC名)」としては勧められていません。「二酸化ケイ素」(Silicon Dioxide)が体系名になります。
(1) ニトログリセリンを心臓の薬として服用するときに、舌の裏側からなめるようにして飲むのはなぜか。(薬理学)
(1a) 正確なことはお医者さんに聞く必要がありますが、たとえば、一度に全部が胃に入ると、胃壁からの吸収速度が速くなりすぎて副作用が大きいというのが、一つの可能性として考えられます。
(2) エネルギーの低い状態がどうして安定なのか?(物理学)
(2a) 自分や他人の行動を観察してみてください。エネルギッシュに活動しているときは、その結果自分も周囲も変化しやすいはず(時には回りのものを壊したり、自分が傷ついたりもする)です。逆に静かに寝ているときは、何も変わらないはずです。分子も同じようなものだと思えばいいのです。
(3)外因性内分泌攪乱物質とは。(環境生理学など)
(3a)環境中にあって、体内に取り込まれると内分泌系に影響を与える物質をさす。英語では external endocrine-disruptors
(EEDS) という。ホルモンの作用を亢進する場合と妨害する場合があり、どちらにしても内分泌系による恒常性の維持や形質の発現に悪影響を及ぼす可能性が懸念されている。俗に「環境ホルモン」と呼ばれたこともあるが、ホルモンとは内分泌物質をさす言葉なので、外因性物質を指して用いるのは不適切であり、避けるべきである。
ホルモン製剤やホルモン類似機能をもつ薬剤が環境に放出された場合にも、内分泌攪乱物質となり得るので、環境問題につながるが、これらは通常はEEDSには含まれない。
(4)物質の合成方法を安価にするにはどうすればいいか?(工業化学)
(4a)次のいくつかの可能性が考えられる。
現実には、すべての条件を同時に満たす最適の合成方法は存在しないので、全体として長所と短所を比較しながら(技術用語で「トレードオフ」という)、なるべく経費の少ない方法を選ぶ。製品の価値と共に、原料等の価格や安全基準・環境基準は年月と共に変化するので、技術者は常により良い製品、より良い方法を模索する必要がある。
たとえば最近は、単に安価な方法を目ざすのではなく、環境負荷が小さく、豊富にあって入手が容易な製品・原料・触媒・副生成物・溶媒を用いる、安全性の高い製造方法を模索する「Green
Sustainable Chemistry (GSC) 」の考え方が、基礎研究から製造現場まで、重要視されるようになっている。
(1) 何のために有機化学をやるのか?
(1a) あらゆる学生に共通する目標を一つ示しておきます。卒業後、日常生活あるいは仕事場で、有機化学の基本的な話題や課題に接したときに、理工学系の大学卒業生として、堂々と胸を張って話題に加わり、課題に取り組めるようになるためです。
(2) 有機化学で学ぶことは、環境関係の勉強にどういう風に生かされるのでしょうか?
(2a) たとえば、本学の海洋環境系の研究室では有機元素分析装置が使われています。有機化学だけでなく、化学の研究の多くの分野でなくてはならない装置です。その他にも、いろいろな場面で有機化学に触れることになるでしょう。どの分野に進んでも「有機化学は要らない」「有機化合物は使わない」ことはありません。具体的には、他の科目やコンタクトグループの先生に聞いてみるといいと思います。
(3) 有機化学の内容が自分で遠い存在に感じられた。身近に感じる方法はないか?
(3a) 身の回りには多数の有機化合物があり、体の中では多数の有機化学反応が起こっています。ただ、これらは構造が複雑で、性質を理解するのは簡単ではありません。「身の回りの現象が必ずしも簡単ではない」のが化学現象の特徴なのです。これを理解するには、まず簡単な物質の構造や性質を理解し、それを手がかりとして取り組む必要があります。両者の間のつながりをとらえるのは簡単ではありませんが、学べば学ぶほど、とらえるための手がかりが増えてくるのは事実です。たとえば、ブドウ糖(グルコース)の立体構造や性質は1年生では考えられない(学んだとしても暗記するしかない)かも知れませんが、4年生になれば有機化学で学んだことからいろいろ類推して考えられるようになります。それがこの講義の目標でもあります。
(4) 有機化学は、どのように勉強していけばいいのか。
(4a) 月並みですが、
(a) 予習をし、わからないポイントを見つけてから、それを聞くために授業に臨む。
(b) 授業をよく聞き、用意した「わからないポイント」の答えが見つからなかったら、先生やTAに質問する。
(c) 演習問題等を通じて理解の程度を確認し、また理解を深める。
に尽きます。
(c) では、講義で学んだ範囲のフォックスあるいはマクマリーの参考書の練習問題、章末問題をすぐに解き、自分で答え合わせをする。わからない問題はテキストや参考書で復習する。そうして得た答えが正解かどうか自信がない場合は、先生かTAに見てもらう。これを繰り返します。
重要なことは、内容をただ覚えるのではなく、学んだことを「使える」ようにすることです。化学で重要なことは、「類推する」ことです。似たものは似たような性質をもち、似たような振る舞いをします。それを一つ一つ覚えることは不可能です。共通点と相違点を判断できるようになれば、覚えることは最小限で済みます。
(5) 予習はどうやってすればいいか?
(5a) プリントの講義予定に沿って教科書を読み、講義資料を見る。必要なら高校あるいは化学(A・B)の教科書の対応する内容を復習する。そして内容に見当を付け、分からない点を明確にしておき、講義に備える。
(6)安い参考書はないか。
(6a)Foxよりも安くてわかりやすい参考書は期待しない方がいい。詳しく説明した参考書(パイン「有機化学(上)」など)は、フレーザー図書館にいろいろ揃っています。片っ端から調べてみて、自分にあった説明の書いてある本を借りるか、コピーするといいでしょう(借りた場合は返却期限を守ること)。
ちなみに、1万円以下なら、大学の専門分野のテキストとしては「安い」と考えるのが常識です。大学生なら、遊ぶための金を惜しんでも、学問するための金と時間を惜しんではいけません。
(7) 参考書として「フォックス・ホワイトセル有機化学」のような分冊の詳しいものと「マクマリー有機化学概説」のような一冊の概説のものとどちらがいいか?
(7a) 何を専門にするかに関係なく、生涯役立てたいなら前者を薦めます。とりあえず講義に役立てばいいのなら後者でもいいでしょう。
(8) 何かよい問題集はないか。
(8a) 大学のテキストで「問題集」に相当するものは、「〜演習」というタイトルの本です。有機化学についてはテキストの「まえがき」で紹介しているものも含めてたくさんあります。
(9) 演習問題などの解答はどうやって確認するのか?
(9a) 解いた問題の正誤はTAに確認してもらって下さい。問題の考え方ががわからないときは、TAにヒントを教わりながら、自分で考えてください。重要なことは、自分で「正解を導けるようになる」ことです。解答例を見てもそれだけでは何の役にも立ちません(この点が数学や物理学と違う点です)。大学の学問は、中学や高校の定期試験対策とはわけが違います。
(10)休み中に読める有機化学に関する本で何かおすすめの本はありませんか?
(10a)講義のためならシラバスやこのサイトの「参考資料」のページに記した参考書。それ以外は、「何のために読むか」により異なります。目的を明確にして問い合わせて下さい。たとえば気軽に読める読み物なら、講義で紹介した
上村明男著「化学は楽しいワンダーランド」(丸善)
がお薦めです。
(11)説明の仕方、理由を聞かれたときの文の書き方が難しいがどうすればいいか。
(11a)説明文には一つ正解があるのではなく、正しい書き方はいくつもあるのですが、そのような経験をこれまで十分に積んでいないので、なおさら難しく感じるのだと思います。自分で書いたものを読み返してから他人に見せるようにし、他人の書いたものを参考にする機会を求め、経験を積めば、誰でもできるようになります。分野に関係なく参考になる本にはたとえば
本多勝一「新装版 日本語の作文技術」(講談社)または「日本語の作文技術」(朝日新聞社)
藤沢晃治「分かりやすい文章の技術」(講談社)
などがあります。
(12)「有機化学I」では生物体に関する物質や反応について学ぶことはできますか。
(12a)生物体に関する物質や反応(生合成や代謝)については「生化学」などで学びます。しかし、「生化学」などでは、大学レベルの有機化学の基礎を学んでいることを前提として授業を行うので、「生化学」で学ぶ内容を理解するには、「有機化学I」の内容を身につけている必要があります(これは「生化学」を教える先生も、学んだ学生さんも例外なく言っていることです)。また、生合成や代謝などの生化学反応をよく理解するには「有機化学II」を学んだほうがいいでしょう。
【化学】および【関連する他分野】の質問と回答も参照してください。
(1) 最新の構造決定の方法は。(分析化学)
(1.1) 構造決定の歴史は?
(2) 遷移元素は有機化学に含まれないのか。遷移元素の関係する有機化合物は一つもないのか。
(3) ATPは有機物か。
(4) 最近のシュガーレス飲料に含まれているマルチトースという糖の構造は?またなぜ体に吸収されにくいのか。
(5) どうして炭素が含まれるものが有機物質なのか?また、例外があるのはどうしてか?
(6) なぜダイヤモンドは有機物ではないのか?
(7) CO2のように炭素を含むのに有機化合物でない例外があるのはどうしてか?
(8) 有機物の定義は?
(8.1) 有機化合物と無機化合物の区別はどうやってするか?
(9) 炭酸、塩酸、サリチル酸などはイオン性か分子性か?電離度との関係は?
(10) 物質の分類の仕方がわからない。
(11) 高分子物質と分子性物質の違いは?
(12) 植物精油は植物油とどう違うのか?([天然物有機化学](1))
(13) 人が初めて作った有機化合物が尿素なのはなぜか?尿素が一番作りやすかったのか?
(14) 新しい物質ができたときに毒性があるとか、頭痛に効くとかどうしてわかるのか?
(15) 天然物の構造を決定したとき、間違っていないかどうか確かめるために全合成をしますが、最近では昔ほど行われないのはなぜか?([天然物有機化学](2))
(16) 単離とは?
(17) クロスカップリングとは何か([有機化学反応概論]Q7)。
(18) 有機化学の構造論、物性論とは?
(19) CCl4は有機物か無機物か?
(20) 有機化合物の毒性は実験してみないとわからないのか、それとも構造からわかるのか?
(21) 炭素の単体である黒鉛は有機物か無機物か?
(22) 化学種とはどのようなものか?
(23) レシチン(リン脂質を含む脂質製品の総称)は分類できますか?
(24) イオン性物質と分子性物質の区別の仕方は?
(25) 着色料はどの分類になりますか?
(1) 命名法のいい覚え方はないか。
(2) テスト等ではIUPAC名と慣用名のどちらを使ってもいいか。
(3) イソプロピル基のイソとはどういう意味か。
(4) 命名法の規則はいくつくらいありますか?
(5) 化合物命名法の官能基の優先順序は覚えるべきか?
(6) IUPAC命名法は英語で書けないといけないのか?アルファベットで書く方がカタカナよりもいいのか?
(7) の主鎖は、右上から枝分かれを下へ向かう部分(CH3CH2C=CHCH2OH)ではないのか(このほうが炭素数が多い)?
(8) 複雑な構造の化合物の名前の付け方を教えてほしい。
(9) 物質名をつけるときに、「イソ-」を付けるときと付けないときがあるのは?
(10) CH3CHClCHBrCH3のIUPAC名は2-ブロモ-3-クロロブタンと3-ブロモ-2-クロロブタンのどちらが正しい?
(11) カルボン酸のカルボンはどういう意味か?
(12)
C4H6の異性体の一つ、![]() のIUPAC名を教えて下さい。
のIUPAC名を教えて下さい。
(13) 「果糖」を「フルクトース」と呼ぶときがあるが、これはどうしてか。
(14) 有機物の名前からおおよその機能を推測することはできるか。
(1) 有機物質の中で不安定なものはなぜ不安定であるのか。
(2) ビニルアルコールはなぜ不安定なのか。
(3) コンピュータを用いる分子モデリングソフトの名前は。
(4) 化学式から異性体がいくつあるかわかるのか。
(5) 異性体を見つけるポイントは。
(6) 異性体を不足なく書くにはどうすればいいか。
(7) 分子式からIHDがわかったあと、構造式を書くにはどうすればいいか。特にIHDが小数の場合。
(8) ラジカルとは何か。
(9) 「完全な構造式」とはどのようなものか?
(10) C−O−O−H(C)という結合は不安定だとすると、どうなるのか。
(11) C-H結合がH-H結合より長い理由は?
(12) 線結合表示では何がどの原子を表しているのか。
(13) 示性式はどのように書けばいいのか。
(14) 異性体を書くのに決まりごと(あってはならない構造)はないのか?
(15) IHDに対応する不飽和結合はCとOの間(Cと他の原子の間)でも考えられるのか?
(16) 構造異性体を書くとき、配座異性体も考えられれば書くのか?
(17) 形式電荷を求めることにより何がわかるか?(無機化学)
(18) 炭素は4価なのに(丸善HGS)分子模型の炭素の「たま」には穴が5つあいているものがあるのはなぜか?
(19) メチル基が左側にあるときに、CH3-と描く場合とH3C-と描く場合があるが、どちらが望ましいか。
(20) ひずみエネルギーとは?どのようにして生じるのか?(立体化学(21)参照。化学結合論)
(21) 結合の極性の有無はどのように判断すればいいのか。
(21a) Q&Aの「化学」(7)を参照して下さい。
(22) Na、K、CaなどとCとの化学結合が不安定なのはどうしてか?
(23) 「元素組成から分子式を区別する」とはどういうことか。
(24) 配位結合は英語でcoordinate bondか、dative bondか?(重要)
(1) σ結合の分子オービタルの図(エネルギー図)は何を表してるのか。
(2) 単結合→σ結合、二重結合→π結合ではないのか?
(3) 炭素・炭素四重結合はなぜ存在しないのか。
(4) 炭素原子の混成状態について、二重結合があるからsp2というわけではないとしたら、sp2かspかはどうやって見極めるのか?
(5) 「非結合性軌道 nonbonding orbital」とは何か。「反結合性軌道 antibonding orbital」とはどう違うか。
(1) シクロアルカンが平面・ほぼ平面・非平面のいずれかを判断する時、考慮するのは炭素原子のみでよいのか?
(2) 二置換シクロアルカンの場合にシスートランス異性体があるのなら、三置換体以上の場合はどうなるのか?
(3) なぜシクロアルカンでは位置異性体をオルト、パラ、メタで呼び分けないのか?
(4) シクロヘキサンにはイス型と舟型があり、一般にはイス型が安定であるが、両者は異性体ではないのか?
(1) 電荷の非局在化というのはどういうことが起こっているのか。また、どのような場合に起こっているのか。
(2) π電子の非局在化は二重結合が二つあるときしか起こらないのか?
(3) 孤立二重結合のπ電子は互いに影響を受けないのか?
(4) 三重結合では共役π電子系はあるか?
(5) 共役π電子系で「二つのπ結合の間」(非局在化しなければ単結合であるところ)のπ電子は左右どっちの電子か見分けるのは本当にできないのか?
(6) 電子が非局在化して安定化するとき、その前の形から変化するのに余分のエネルギー(活性化エネルギーのことか?)は必要ないのか?
(7) 「半定量的」とはどういう意味か?
(8) 限界構造式を描くときに、どの部分にまず注目すればいいか?
(9) 限界構造式で考えるときに、上下や左右をひっくり返せば全く同じ構造を2つ描くのはなぜか?
(10) 結合の長さの表で、sp2混成のC−C(単)結合の長さとC=C(二重)結合の長さの違いは何によるのか?
(11) ブタジエンやベンゼンなど炭化水素の非局在化を考えるとき、対イオン(「プラスとマイナスに分かれている」もの)ではなく、不対電子が2つあるような限界構造式は考えないのですか。
(12) 上の質問で、対イオンでは分子内にプラスとマイナスの電荷が分かれて存在していて、不安定ではないのですか。
(13) ベンゼン環を描くときに、六角形の中に○を描く方法でもいいのか。
(1) 極性や水素結合によって沸点が高くなるのはなぜか?
(2) 沸点の高低を考えるときに極性と水素結合はどちらを優先して考えればいいか?
(3) (たとえばカルボキシル基の)一個の酸素原子が二個のドナー水素と水素結合することは絶対にあり得ないのか?
(4) 極性の大きい分子、水素結合している分子が水に溶けやすいのはなぜか?
(5) 構造異性体を式で書くときに、考えられても書いてはいけない構造はあるか?
(6) 有機化合物の炭素原子に結合した水素原子を他の原子に変えたら、形や結合角は変わるのか?
(1) 立体化学がよくわからないので、安い参考書を教えて下さい。
(2) 次の2つの構造は名前が違うのか?
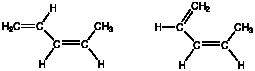
(3) どのようなときにE、Zを使い、どのようなときにcis、trans を使うのか。
(4) 「幾何異性体」は「シス・トランス異性体」が正しいのか?
(5) 配座異性体のエネルギーの求め方は?
(6) 配座異性体のエネルギー差はどのようにして求めればいいのか。
(7) シクロヘキサンの舟形やねじれ形は実在するのか?
(8) 置換シクロヘキサンの立体構造で、cisとtransはどうやって区別すればいいか。
(9) ひずみエネルギーとは?どのようにして生じるのか?(化学結合論)
(10) ひずみエネルギーの物理的な原因は?
(11) ねじれ形と重なり形では、なぜねじれ形のほうが安定なのか?
(1) キラル中心の見分け方は?
(2) R-体、S-体の簡単な見分け方はありませんか?
(3) Fischer投影式から立体構造を想像できるようになるにはどうすればいいですか。
(4)「キラル」とはどういう意味か?
(5) キラルな分子はどうして旋光性を示すのか?
(6) 絶対配置のR(時計回り)・S(反時計回り)は、旋光性の+(時計回り)−(反時計回り)と対応しているのか?
(7) 旋光性の回転方向はどのように判断(予測)すればいいのか?
(8) 絶対立体配置とは?
(9) メソ体は対称面がないとだめなのですか?
(10) 結合がいくつもあるとき、どこを視点として優先順位を考えればいいのか?
(11) 環を構成する異なる(炭素)原子にそれぞれ1つずつ置換基が結合したときにできる立体異性体は幾何異性体か、それとも光学異性体か?
(12) Fischer投影式で書く場合とそうでない時とではどういう違いがあるのか。また、それは何のためか?
(13) Fischer投影式の上下の置き方はどんな場合でも決まっているのか?
(14) ジアステレオ異性体の分離が容易なのはどうしてか。
(1) 植物精油は植物油とどう違うのか?
(2) 天然物の構造を決定したとき、間違っていないかどうか確かめるために全合成をしますが、最近では昔ほど行われないのはなぜか?
(3) 全合成とは?
(4) 細胞の染色に使われる酢酸カーミンとカルミン酸とは何か関係があるか?
(5) 私たちの体の中に入っていくものには有機物が多いのはどうしてか?
(6) 天然の藍色の色素の化学式は?
【化学】および【関連する他分野】の質問と回答も参照してください。
Q1. なぜCH3が電子供与基なのですか?
Q2. メトキシ基、エトキシ基の酸素は共役系に関与しますか?
Q3. π、n電子の非局在化が大きいと、なぜ長波長で吸収が起こるのか。
Q4. メチルオレンジがpHにより変色するのはなぜか?メチルレッドもアゾ化合物か?(分析化学)
Q5. −CH2+と−CH2-の状態の違いは?
Q6. 正電荷の非局在化と負電荷の非局在化では、化学的性質の違いがあるのか?
Q7. 非局在化効果と誘起効果はどう違うのか。
Q8. o-ニトロアニリンやp-ニトロアニリンの場合のように、NO2基とNH2基があるときに、なぜNH2による電子供与性の非局在化効果が働いて、NO2による電子求引性の非局在化効果が働かないのか?
Q9. 非局在化効果(共鳴効果)について書いているわかりやすい本はないか?
Q10. 限界構造式を描いたときに「寄与が大きい」とはどういうことか。
Q1. 酸性の強さに対して水素結合はどのくらいの影響を与えるか。
Q2. フェノールのp-NH2、o-CH3、p-CH3置換体のpKaが等しいのはなぜか?
Q3. 過酸の酸性度はカルボン酸に比べて強いのか?
Q4. 窒素化合物の中で、sp3混成のアミンの塩基性がもっとも強いのはどうしてか?(イミン、ニトリルの順に塩基性は弱くなる)
Q1. エステル化ではなぜアルコールの-OHからHがとれて、カルボキシル基-COOHのOHがとれて脱水するのか。
Q2. 「接近する」という表現を用いているが、どちらが接近してくるかは決まっているのか?
Q3. プリントではE+とH+、Nu-とB-を区別して書いてあるが、区別して考えるべきなのか?
Q4. 与えられた有機化合物のどこでどんな反応が起こるかを知るにはどのようなことに注目すればいいのか?(回答改訂)
Q5. 反応経路を考えているとすぐに行き詰まってわからなくなるが、そんなときはどうすればいいのか?
Q6. 有機化学反応で、反応物、試薬、触媒、反応条件が与えられたとき、どんな反応が起こり、何が生成するかをどのように筋道を立てて考えればいいか?
Q7. クロスカップリングとはどのような反応か。
Q8. 異性化反応とは?
Q9. ハロゲン化炭化水素が燃えにくいのはどうしてか。
Q1. SN1とかSN2の意味は?
Q2. SN1とSN2の違いは?
Q3. 反応機構はどう考えればいいのか。SN、Eのどれが起こるかは、表を暗記して判断するのか?
Q4. なぜアルコールは水酸化ナトリウムのように解離してOH-を生じないのか?
Q1. なぜα位でなくβ位の水素がとれるのですか?
Q2. Hofmann脱離の場合に、N-CH3結合が切れないのはなぜか。
Q1. HBrにラジカル開始剤が作用するときに、Br・とH・の両方ができてアルケンと反応するのか、Br・だけが最初にできて、その後HBrからH・ができて反応するのか、どちらか?
Q2. オゾニドになるしくみがわかりません。
Q3. オゾン酸化でエポキシ環ができないのはなぜか。
Q4. ラジカルとは何か?
Q1. 活性化基が位置を決めるというが、その位置が複数あるときはどうなるか。
Q2. ベンゼン環に官能基が2つ以上ついているものの反応は、参考書のどこを見ればいいのか。
Q3. 「マクマリー有機化学概説」(第7版)の158ページの(ベンゼンと臭素からブロモベンゼンが生じる)反応のエネルギー図ではこの反応は発熱反応であり、ベンゼンよりブロモベンゼンのほうが安定であると書かれている。Brは電気陰性度が大なのでベンゼン環の電子を奪い、不安定化してしまうのではないかと考えたが、どの様に考えれば、上の図を説明することができるか。
Q4. アニリン塩酸塩を亜硝酸ナトリウムと反応させて、ベンゼンジアゾニウム塩を生じる反応の機構は?
Q1. 例えばアセトフェノンとフェニルヒドラジンからフェニルヒドラゾンを生成する場合と、フェニルヒドラジンの代わりにエチルアミンと反応させたときの反応機構はどのように書けばいいのか。
Q2. ケトンとヒドラジンなど窒素化合物との反応は酸性条件下で行われますが、このときNはプロトン化されないのか?
Q1. 酸化剤を使って酸化するときに、酸性下と塩基性下では何が違うのか?
Q2. アルケンへの接触水素化反応で水素がcis付加するのはなぜか?
2022年5月16日改訂